题目内容
下列事实中,能证明氯化氢是强电解质的是( )
| A、氯化氢易溶于水 |
| B、氯化氢水溶液能导电 |
| C、氯化氢在水溶液中完全电离 |
| D、氯化氢易挥发 |
考点:强电解质和弱电解质的概念
专题:
分析:完全电离的电解质为强电解质,强酸、强碱和大部分的盐、金属氧化物等都是强电解质.
解答:
解:A、易溶于水的物质不一定是强电解质,如醋酸,故A错误;
B、水溶液能导电的物质不一定是强电解质,如二氧化硫为非电解质,故B错误;
C、氯化氢在水溶液里完全电离,说明氯化氢是强电解质,故C正确;
D、易挥发的物质不一定是强电解质,如酒精,故D错误;
故选C.
B、水溶液能导电的物质不一定是强电解质,如二氧化硫为非电解质,故B错误;
C、氯化氢在水溶液里完全电离,说明氯化氢是强电解质,故C正确;
D、易挥发的物质不一定是强电解质,如酒精,故D错误;
故选C.
点评:本题考查了强电解质的判断,根据电解质的电离程度划分强弱电解质,与溶液的导电性、是否挥发、物质的溶解性等都无关,为易错点.

练习册系列答案
相关题目
将2.24g的铁粉加入50ml2mol?L-1的氯化铁溶液中,充分反应后,其结果是( )
| A、铁有剩余,溶液呈浅绿色,Cl-浓度基本不变 |
| B、往溶液中滴入KSCN无色溶液,不显红色 |
| C、氧化产物与还原产物的物质的量之比为2:5 |
| D、Fe2+、Fe3+的物质的量之比为6:1 |
有Na2SO4、Fe2(SO4)3和NaNO3的混合溶液,已知其中Fe3+的物质的量浓度为0.4mol/L,SO42-的物质的量浓度为0.7mol/L,NO3-的物质的量浓度为0.2mol/L,则此溶液中Na+的物质的量浓度为(不考虑Fe3+在溶液中的反应)( )
| A、0.2mol/L |
| B、0.3mol/L |
| C、0.4mol/L |
| D、0.35mol/L |
下列物质的水溶液中,呈碱性的是( )
| A、CH3COONa |
| B、Na2SO4 |
| C、NH4Cl |
| D、KAl (SO4)2 |
下列说法正确的是( )
| A、难溶于水的物质一定是非电解质 |
| B、能导电的物质一定是电解质 |
| C、某物质若不是电解质,就一定是非电解质 |
| D、溶于水能电离出自由移动的离子的化合物是电解质 |
下列变化会放出热量的是( )
| A、碘升华 |
| B、冰融化 |
| C、氢分子变成氢原子 |
| D、镁和盐酸反应 |
下列叙述正确的是( )
| A、1molH2SO4的质量为98g/mol |
| B、摩尔是7个基本物理量之一 |
| C、6.02×1022个H2SO4分子的质量为9.8g |
| D、CO2的摩尔质量是44g |
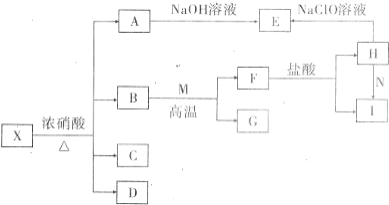 固体X是由两种常见元素组成的化合物.其中金属元素与另一元素的质量比为14:1.在一定条件下X可发生如下转化(部分产物未标出).C是无色无昧且能使澄清石灰水变浑浊的气体,D为红棕色气体,E为红褐色沉淀,M为常见金属单质.
固体X是由两种常见元素组成的化合物.其中金属元素与另一元素的质量比为14:1.在一定条件下X可发生如下转化(部分产物未标出).C是无色无昧且能使澄清石灰水变浑浊的气体,D为红棕色气体,E为红褐色沉淀,M为常见金属单质.