题目内容
下列离子方程式中正确的是( )
| A、向FeBr2溶液中通入过量氯气:2Fe2++Cl2=2Fe3++2Cl- |
| B、向稀硫酸加入少量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| C、碳酸氢铵溶液与足量的NaOH溶液共热,NH4++OH-?NH3↑+H2O |
| D、鸡蛋壳和醋酸溶液的主要反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
考点:离子方程式的书写
专题:
分析:A.过量氯气,亚铁离子和溴离子均全部被氧化;
B.反应生成硫酸钡和水,符合离子的配比;
C.漏写碳酸氢根离子与碱的反应;
D.醋酸在离子反应中保留化学式.
B.反应生成硫酸钡和水,符合离子的配比;
C.漏写碳酸氢根离子与碱的反应;
D.醋酸在离子反应中保留化学式.
解答:
解:A.向FeBr2溶液中通入过量氯气的离子反应为4Br-+2Fe2++3Cl2=2Fe3+++2Br2+6Cl-,故A错误;
B.向稀硫酸加入少量Ba(OH)2溶液的离子反应为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故B正确;
C.碳酸氢铵溶液与足量的NaOH溶液共热的离子反应为HCO3-+NH4++2OH-?NH3↑+2H2O+CO32-,故C错误;
D.鸡蛋壳和醋酸溶液的离子反应为CaCO3+2HAc=Ca2++H2O+CO2↑+2Ac-,故D错误;
故选B.
B.向稀硫酸加入少量Ba(OH)2溶液的离子反应为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故B正确;
C.碳酸氢铵溶液与足量的NaOH溶液共热的离子反应为HCO3-+NH4++2OH-?NH3↑+2H2O+CO32-,故C错误;
D.鸡蛋壳和醋酸溶液的离子反应为CaCO3+2HAc=Ca2++H2O+CO2↑+2Ac-,故D错误;
故选B.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应的考查,综合性较强,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
下列说法正确的是( )
| A、常温下0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(Na+)>c(B-)>c(H+)>c(OH-) |
| B、常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)不相等 |
| C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
| D、0.lmol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) |
将2.24g的铁粉加入50ml2mol?L-1的氯化铁溶液中,充分反应后,其结果是( )
| A、铁有剩余,溶液呈浅绿色,Cl-浓度基本不变 |
| B、往溶液中滴入KSCN无色溶液,不显红色 |
| C、氧化产物与还原产物的物质的量之比为2:5 |
| D、Fe2+、Fe3+的物质的量之比为6:1 |
下列反应的离子方程式正确的是( )
| A、锌片插入硝酸银溶液中:Zn+Ag+═Zn2++Ag |
| B、将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- |
| C、少量金属钠加到冷水中:Na+2H2O═Na++OH-+H2↑ |
| D、氢氧化铜加到盐酸中:Cu(OH)2+2H+═Cu2++2H2O |
今有如下5个热化学方程式:
H2(g)+
O2(g)=H2O(g)△H=a kJ?mol-1
H2(g)+
O2(g)=H2O(l)△H=b kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=c kJ?mol-1
C(s)+
O2(g)═CO(g)△H=-Q1kJ?mol-1
C(s)+O2(g)═CO2(g)△H=-Q2kJ?mol-1
有关上述反应的叙述错误的是( )
H2(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
2H2(g)+O2(g)=2H2O(l)△H=c kJ?mol-1
C(s)+
| 1 |
| 2 |
C(s)+O2(g)═CO2(g)△H=-Q2kJ?mol-1
有关上述反应的叙述错误的是( )
| A、0<Q1<Q2 | ||
| B、上述反应中反应物总能量均高于生成物总能量 | ||
| C、氢气的标准燃烧热是a kJ?mol-1,碳的标准燃烧热是Q2kJ?mol-1 | ||
D、a>b=
|
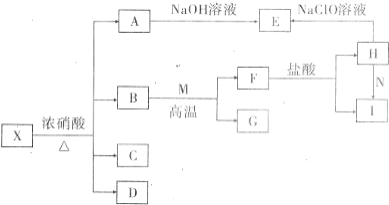 固体X是由两种常见元素组成的化合物.其中金属元素与另一元素的质量比为14:1.在一定条件下X可发生如下转化(部分产物未标出).C是无色无昧且能使澄清石灰水变浑浊的气体,D为红棕色气体,E为红褐色沉淀,M为常见金属单质.
固体X是由两种常见元素组成的化合物.其中金属元素与另一元素的质量比为14:1.在一定条件下X可发生如下转化(部分产物未标出).C是无色无昧且能使澄清石灰水变浑浊的气体,D为红棕色气体,E为红褐色沉淀,M为常见金属单质.