题目内容
元素周期表短周期中七种元素的原子序数与主要化合价的关系如图:
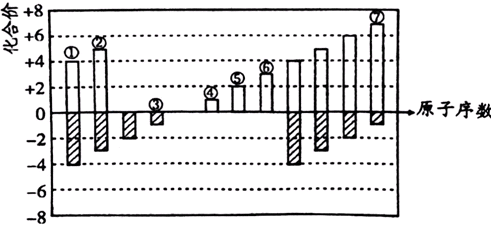
已知⑥的最高价氧化物为两性氧化物,回答下列问题:
(1)写出元素⑦在周期表中的位置 ;元素④和元素⑥的最高价氧化物的水化物中碱性较强的是 (用化学式表示).
(2)元素③与元素⑤形成的化合物属于 (填“共价”或“离子”)化合物;元素②的气态氢化物的电子式为 .
(3)元素⑥的离子结构示意图 ;元素①的最高价氧化物结构式为 ;元素①-⑦中原子半径最大的是 (填序号),所形成的单质中能形成原子晶体的是 (填序号);元素⑦分别于①和④所形成的化合物中,熔点较高的物质的化学式为 .
(4)写出证明⑥的最高价氧化物的两性物质的化学反应的离子方程式: , .

已知⑥的最高价氧化物为两性氧化物,回答下列问题:
(1)写出元素⑦在周期表中的位置
(2)元素③与元素⑤形成的化合物属于
(3)元素⑥的离子结构示意图
(4)写出证明⑥的最高价氧化物的两性物质的化学反应的离子方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:由短周期中七种元素的原子序数与主要化合价的关系可知,③只有-1价,为F;④只有+1价,为Na;①有+4和-4价,则为C,②有-3和+5价,则为N;⑥的最高价氧化物为两性氧化物,⑥为Al,⑤⑦分别为Mg、Cl,然后结合元素及其化合物的性质来解答.
解答:
解:由短周期中七种元素的原子序数与主要化合价的关系可知,③只有-1价,为F;④只有+1价,为Na;①有+4和-4价,则为C,②有-3和+5价,则为N;⑥的最高价氧化物为两性氧化物,⑥为Al,⑤⑦分别为Mg、Cl,
(1)⑦为氯元素,位于周期表的第三周期第ⅤⅡA族,钠的金属性比铝强,所有它们的最高价氧化物的水化物中碱性较强的是NaOH,故答案为:第三周期第ⅤⅡA族;NaOH;
(2)氟有较强的非金属性,镁有较强的金属性,它们形成的化合物离子化合物,氨气的电子式为 ,故答案为:离子;
,故答案为:离子; ;
;
(3)铝离子结构示意图为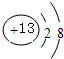 ;二氧化碳的结构式为O=C=O;根据元素周期律,电子层数越多的半径越大,电子层数相同的,原子序数越大的,半径越小,所以①-⑦中原子半径最大的是钠,所形成的单质中能形成原子晶体的是金刚石,在CCl4和NaCl中,由于CCl4是分子晶体,NaCl是离子晶体,所以熔点较高的物质是NaCl,故答案为:
;二氧化碳的结构式为O=C=O;根据元素周期律,电子层数越多的半径越大,电子层数相同的,原子序数越大的,半径越小,所以①-⑦中原子半径最大的是钠,所形成的单质中能形成原子晶体的是金刚石,在CCl4和NaCl中,由于CCl4是分子晶体,NaCl是离子晶体,所以熔点较高的物质是NaCl,故答案为: ;O=C=O;④;①;NaCl;
;O=C=O;④;①;NaCl;
(4)氧化铝既可与强酸反应,又能与强碱反应,就可证明氧化铝为两性氧化物,有关离子方程式为2Al+6H+=2Al3++3H2↑,Al2O3+2OH-=AlO2-+2H2O,故答案为:2Al+6H+=2Al3++3H2↑;Al2O3+2OH-=AlO2-+2H2O.
(1)⑦为氯元素,位于周期表的第三周期第ⅤⅡA族,钠的金属性比铝强,所有它们的最高价氧化物的水化物中碱性较强的是NaOH,故答案为:第三周期第ⅤⅡA族;NaOH;
(2)氟有较强的非金属性,镁有较强的金属性,它们形成的化合物离子化合物,氨气的电子式为
 ,故答案为:离子;
,故答案为:离子; ;
;(3)铝离子结构示意图为
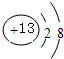 ;二氧化碳的结构式为O=C=O;根据元素周期律,电子层数越多的半径越大,电子层数相同的,原子序数越大的,半径越小,所以①-⑦中原子半径最大的是钠,所形成的单质中能形成原子晶体的是金刚石,在CCl4和NaCl中,由于CCl4是分子晶体,NaCl是离子晶体,所以熔点较高的物质是NaCl,故答案为:
;二氧化碳的结构式为O=C=O;根据元素周期律,电子层数越多的半径越大,电子层数相同的,原子序数越大的,半径越小,所以①-⑦中原子半径最大的是钠,所形成的单质中能形成原子晶体的是金刚石,在CCl4和NaCl中,由于CCl4是分子晶体,NaCl是离子晶体,所以熔点较高的物质是NaCl,故答案为: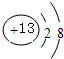 ;O=C=O;④;①;NaCl;
;O=C=O;④;①;NaCl;(4)氧化铝既可与强酸反应,又能与强碱反应,就可证明氧化铝为两性氧化物,有关离子方程式为2Al+6H+=2Al3++3H2↑,Al2O3+2OH-=AlO2-+2H2O,故答案为:2Al+6H+=2Al3++3H2↑;Al2O3+2OH-=AlO2-+2H2O.
点评:本题考查原子结构与元素周期律的关系,把握元素的化合价及原子序数关系推断元素为解答的关键,涉及的知识点较多,综合性较强,题目难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
下列变化会放出热量的是( )
| A、碘升华 |
| B、冰融化 |
| C、氢分子变成氢原子 |
| D、镁和盐酸反应 |
FeCl3溶液和Fe(OH)3 胶体共同具备的性质是( )
| A、分散质的粒子都可以通过滤纸 |
| B、胶体是介稳定的,所以Fe(OH)3 胶体密封一段时间也会产生沉淀 |
| C、都能产生丁达尔效应 |
| D、加入盐酸先产生沉淀,然后沉淀溶解 |
如果1g水中含有m个氢原子,则阿伏加德罗常数是( )mol-1.
A、
| ||
| B、9m | ||
| C、2m | ||
| D、18m |
下列叙述正确的是( )
| A、1molH2SO4的质量为98g/mol |
| B、摩尔是7个基本物理量之一 |
| C、6.02×1022个H2SO4分子的质量为9.8g |
| D、CO2的摩尔质量是44g |
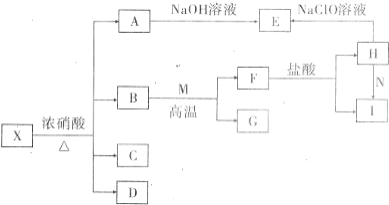 固体X是由两种常见元素组成的化合物.其中金属元素与另一元素的质量比为14:1.在一定条件下X可发生如下转化(部分产物未标出).C是无色无昧且能使澄清石灰水变浑浊的气体,D为红棕色气体,E为红褐色沉淀,M为常见金属单质.
固体X是由两种常见元素组成的化合物.其中金属元素与另一元素的质量比为14:1.在一定条件下X可发生如下转化(部分产物未标出).C是无色无昧且能使澄清石灰水变浑浊的气体,D为红棕色气体,E为红褐色沉淀,M为常见金属单质.