题目内容
关于下列各装置图的叙述不正确的是( )


| A、用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 |
| B、图②装置的盐桥中KCl的Cl-移向甲烧杯 |
| C、图③装置中钢闸门应与外接电源的负极相连获得保护 |
| D、装置④中Ag电极发生反应:2H2O+2e-=H2↑+2OH- |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.电解精炼粗铜时,粗铜作阳极、纯铜作阴极、硫酸铜为电解质;
B.含有盐桥的原电池中,盐桥中阴离子流向负极区、阳离子流向正极区;
C.作电解池阴极的金属被保护,作电解池阳极的金属加速被腐蚀;
D.该装置发生吸氧腐蚀属于原电池,Fe易失电子发生氧化反应,Ag电极上氧气得电子发生还原反应.
B.含有盐桥的原电池中,盐桥中阴离子流向负极区、阳离子流向正极区;
C.作电解池阴极的金属被保护,作电解池阳极的金属加速被腐蚀;
D.该装置发生吸氧腐蚀属于原电池,Fe易失电子发生氧化反应,Ag电极上氧气得电子发生还原反应.
解答:
解:A.电解精炼粗铜时,粗铜作阳极、纯铜作阴极、硫酸铜为电解质,根据电流流向知,a是阳极、b是阴极,则a是粗铜、b是纯铜,故A正确;
B.含有盐桥的原电池中,盐桥中阴离子流向负极区、阳离子流向正极区,该装置中Zn作负极、Cu作正极,所以盐桥中KCl的Cl-移向甲烧杯,故B正确;
C.作电解池阴极的金属被保护,作电解池阳极的金属加速被腐蚀,要保护钢铁,则钢铁连接原电池负极,故C正确;
D.该装置发生吸氧腐蚀属于原电池,Fe易失电子发生氧化反应,Ag电极上氧气得电子发生还原反应,正极反应式为O2+2H2O+4e-=4OH-,故D错误;
故选D.
B.含有盐桥的原电池中,盐桥中阴离子流向负极区、阳离子流向正极区,该装置中Zn作负极、Cu作正极,所以盐桥中KCl的Cl-移向甲烧杯,故B正确;
C.作电解池阴极的金属被保护,作电解池阳极的金属加速被腐蚀,要保护钢铁,则钢铁连接原电池负极,故C正确;
D.该装置发生吸氧腐蚀属于原电池,Fe易失电子发生氧化反应,Ag电极上氧气得电子发生还原反应,正极反应式为O2+2H2O+4e-=4OH-,故D错误;
故选D.
点评:本题考查原电池和电解池,明确电解精炼、金属腐蚀与防护、离子移动方向等知识点即可解答,熟练掌握原电池和电解池原理,易错选项是B.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
下列说法错误的是( )
| A、某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 |
| B、硅酸盐NaAISiO4.nH2O可改写成氧化物形式为:Na2O.AI2O3.2SiO2.2nH2O |
| C、AI65Cu23Fe12是一种拟晶,具有合金的优良物理性能,其硬度比金属Al、Cu、Fe都大 |
| D、过量铁与浓硫酸加热反应可以得到氢气 |
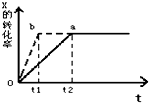 图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)?2Z(g)+W(g);△H=QkJ/mol 的反应过程. 若使a曲线变为b曲线,可采取的措施是( )
图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)?2Z(g)+W(g);△H=QkJ/mol 的反应过程. 若使a曲线变为b曲线,可采取的措施是( )| A、增大Y的浓度 |
| B、加入催化剂 |
| C、降低温度 |
| D、增大体系压强 |
下列对事实的说法、解释或结论正确的是( )
| A、酸根离子中不可能含有金属元素 |
| B、铁比铝容易生锈,是因为铁比铝活泼 |
| C、向某溶液中滴加KSCN溶液,溶液呈血红色,证明存在Fe3+而没有Fe2+ |
| D、铝箔在酒精灯火焰山加热熔化但不滴落,因为铝箔表面的氧化铝熔点高于铝 |
pH、体积都相同的醋酸和硫酸,分别跟足量的碳酸钠溶液反应,在相同条件下,放出二氧化碳气体的体积是( )
| A、醋酸多 | B、硫酸多 |
| C、一样多 | D、无法比较 |
下列电离或水解方程式正确的是( )
| A、Na2SO3的水解:SO3 2-+2H2O?H2SO3+2OH- |
| B、NaHCO3的电离:NaHCO3?Na++H++CO3 2- |
| C、KHS的电离:KHS=K++HS- |
| D、NaClO溶液与FeCl2溶液混合:2ClO-+Fe2++2H2O=2HClO+Fe(OH)2↓ |
下列溶液中Cl-的物质的量与50mL 1mol?L-1 AlCl3溶液中Cl-物质的量相等的( )
| A、25 mL 2 mol?L-1的KCl溶液 |
| B、75 mL 2 mol?L-1KClO3溶液 |
| C、150 mL 1 mol?L-1的NaCl溶液 |
| D、75 mL 1 mol?L-1的FeCl3溶液 |