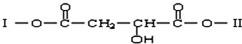题目内容
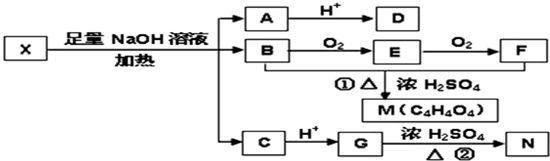
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)元素Z位于周期表中第 周期、 族;
(2)Y的最高价氧化物的化学式为 ;
(3)XW2的电子式为 ;
(4)W元素的单质在一定条件可以和W最高价氧化物对应水化物反应,产物为两种氧化物.该反应的化学方程式为 .
| X | Y | |
| Z | W |
(1)元素Z位于周期表中第
(2)Y的最高价氧化物的化学式为
(3)XW2的电子式为
(4)W元素的单质在一定条件可以和W最高价氧化物对应水化物反应,产物为两种氧化物.该反应的化学方程式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W均为短周期主族元素,由位置关系可知,X、Y处于第二周期,Z、W处于第三周期,Z元素原子核外电子总数是其最外层电子数的3倍,设核外最外层电子数为x,则有(2+8+x)=3x,解得x=5,则Z为P元素,故X为C元素、Y为N元素、W为S元素,据此解答.
解答:
解:X、Y、Z、W均为短周期主族元素,由位置关系可知,X、Y处于第二周期,Z、W处于第三周期,Z元素原子核外电子总数是其最外层电子数的3倍,设核外最外层电子数为x,则有(2+8+x)=3x,解得x=5,则Z为P元素,故X为C元素、Y为N元素、W为S元素,
(1)元素Z为P元素,位于周期表中第三周期VA族,故答案为:三;VA;
(2)Y为N元素,最高正价为+5,最高价氧化物的化学式为N2O5,故答案为:N2O5;
(3)CS2中碳原子与氧原子之间形成2对共用电子对,电子式为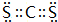 ,故答案为:
,故答案为: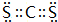 ;
;
(4)硫与浓硫酸在加热条件下反应生成二氧化硫与水,该反应的化学方程式为:2H2SO4(浓)+S
3SO2↑+2H2O,故答案为:2H2SO4(浓)+S
3SO2↑+2H2O.
(1)元素Z为P元素,位于周期表中第三周期VA族,故答案为:三;VA;
(2)Y为N元素,最高正价为+5,最高价氧化物的化学式为N2O5,故答案为:N2O5;
(3)CS2中碳原子与氧原子之间形成2对共用电子对,电子式为
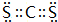 ,故答案为:
,故答案为: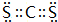 ;
;(4)硫与浓硫酸在加热条件下反应生成二氧化硫与水,该反应的化学方程式为:2H2SO4(浓)+S
| ||
| ||
点评:本题考查结构性质位置关系综合应用,计算推断元素是解题关键,注意对基础知识的理解掌握.

练习册系列答案
相关题目
在体积相同的A、B两个带活塞的玻璃容器中,分别注入
体积颜色相同的NO2与溴蒸气,然后将活塞同时向外拉出到
(快速),过一会可以看到( )
| 1 |
| 4 |
| 1 |
| 2 |
| A、A中的颜色比B中的浅 |
| B、A中的颜色比B中的深 |
| C、A中的颜色与B中的深浅相同 |
| D、A中颜色比开始时深 |
关于下列各装置图的叙述不正确的是( )


| A、用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 |
| B、图②装置的盐桥中KCl的Cl-移向甲烧杯 |
| C、图③装置中钢闸门应与外接电源的负极相连获得保护 |
| D、装置④中Ag电极发生反应:2H2O+2e-=H2↑+2OH- |
下列事实可以得出最后结论的是( )
| A、常温下,反应:C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H<0 | ||
B、一定温度下,反应:MgO(l)═Mg(l)+
| ||
| C、CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | ||
| D、已知反应:C(s)+H2O(g)→CO(g)+H2(g)△H=+131.4kJ,该反应在常温下一定可自发进行 |
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
| A、在自然界中只以化合态的形式存在 |
| B、单质常用作半导体材料和光导纤维 |
| C、最高价氧化物不与任何酸反应 |
| D、气态氢化物很稳定,受热不易分解 |
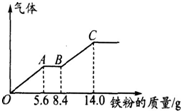 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A、H2SO4浓度为2.5 mol?L-1 |
| B、第二份溶液中最终溶质为FeSO4 |
| C、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 |
| D、原混合酸中NO3-物质的量为0.1mol |
1L稀硝酸和稀硫酸的混合溶液,其溶质的物质的量浓度分别为0.1mol/L 和0.4mol/L.若向该混合溶液中加入足量的铜粉.则最多能溶解铜粉的质量为( )
| A、2.4 g |
| B、3.2 g |
| C、6.4 g |
| D、9.6 g |