题目内容
为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2.已知:
2CO(g)+O2(g)=2CO2(g);△H=-566kJ?moL-1
2H2(g)+O2(g)=2H2O(g);△H=-483.6KJ?moL-1
H2O (g)=H2O(l);△H=-44.0KJ?moL-1
(1)氢气的燃烧热△H= kJ?moL-1
(2)①写出CO和H2O(g)作用生成CO2和H2的热化学方程式
②往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为 ;反应达到平衡后,升高温度,平衡将向 (填“正”或“逆”)方向移动
③为了提高CO的转化率,可采取的措施是 .
A.增大的CO浓度 B.增大的H2O(g)浓度 C.使用催化剂 D.降低温度
(3)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是 .
2CO(g)+O2(g)=2CO2(g);△H=-566kJ?moL-1
2H2(g)+O2(g)=2H2O(g);△H=-483.6KJ?moL-1
H2O (g)=H2O(l);△H=-44.0KJ?moL-1
(1)氢气的燃烧热△H=
(2)①写出CO和H2O(g)作用生成CO2和H2的热化学方程式
②往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为
③为了提高CO的转化率,可采取的措施是
A.增大的CO浓度 B.增大的H2O(g)浓度 C.使用催化剂 D.降低温度
(3)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是
考点:有关反应热的计算,热化学方程式,化学电源新型电池,化学平衡的影响因素,化学平衡的计算
专题:
分析:(1)通常条件下,1mol氢气完全燃烧生成液态水放出的热量为氢气的燃烧热.利用盖斯定律,根据已知热化学方程式乘以合适的系数进行相应加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减,据此书写判断;
(2)①利用盖斯定律,根据已知热化学方程式乘以合适的系数进行相应加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减;
②令参加反应的CO的物质的量为nmol,利用三段式用n表示出平衡时各组分的物质的量,由于各物质的化学计量数都为1,用物质的量代替浓度代入平衡常数计算n的值,再利用转化率定义计算;升高温度平衡向吸热反应移动,结合①中的热化学方程式判断,升高温度平衡移动方向;
③为了提高CO的转化率,应使平衡向正反应移动,结合选项判断平衡移动进行判断.注意增大CO的浓度,平衡向正反应移动,但CO的转化率降低;
(3)原电池负极发生氧化反应,氢气在负极放电,在碱性条件下,氢气放电生成水.
(2)①利用盖斯定律,根据已知热化学方程式乘以合适的系数进行相应加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减;
②令参加反应的CO的物质的量为nmol,利用三段式用n表示出平衡时各组分的物质的量,由于各物质的化学计量数都为1,用物质的量代替浓度代入平衡常数计算n的值,再利用转化率定义计算;升高温度平衡向吸热反应移动,结合①中的热化学方程式判断,升高温度平衡移动方向;
③为了提高CO的转化率,应使平衡向正反应移动,结合选项判断平衡移动进行判断.注意增大CO的浓度,平衡向正反应移动,但CO的转化率降低;
(3)原电池负极发生氧化反应,氢气在负极放电,在碱性条件下,氢气放电生成水.
解答:
解:(1)已知:①2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ?moL-1
②H2O (g)=H2O(l)△H=-44.0KJ?moL-1
根据盖斯定律,①×
+②得H2(g)+
O2(g)=H2O(l)△H=
×(-483.6KJ?moL-1)+(-44.0KJ?moL-1)=-285.8KJ?moL-1;
故答案为:-285.8;
(2)①已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ?moL-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ?moL-1
根据盖斯定律,①-②得2CO(g)+2H2O(g)=2H2(g)+2CO2(g)△H=-566kJ?moL-1-(-483.6KJ?moL-1)=-82.4KJ?moL-1.
即CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ?moL-1.
故答案为:CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ?moL-1;
②令参加反应的CO的物质的量为nmol,则:
CO(g)+H2O(g)=H2(g)+CO2(g)
开始(mol):1 1 0 0
变化(mol):n n n n
平衡(mol):1-n 1-n n n
所以
=1,解得n=0.5,故t℃时CO的转化率为
×100%=50%;
由①可知该反应正反应是放热反应,升高温度平衡向逆反应移动,
故答案为:50%;逆;
③A.增大的CO浓度,平衡向正反应移动,但CO的转化率降低,故A错误;
B.增大的H2O(g)浓度,平衡向正反应移动,但CO的转化率增大,故B正确;
C.使用催化剂加快反应速率,平衡不移动,CO转化率不变,故C错误;
D.降低温度平衡向正反应移动,但CO的转化率增大,故D正确.
故答案为:BD;
(3)原电池负极发生氧化反应,氢气在负极放电,在碱性条件下,氢气放电生成水,负极电极反应式为H2-2e-+2OH-═2H2O,
故答案为:H2-2e-+2OH-═2H2O.
②H2O (g)=H2O(l)△H=-44.0KJ?moL-1
根据盖斯定律,①×
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:-285.8;
(2)①已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ?moL-1
②2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ?moL-1
根据盖斯定律,①-②得2CO(g)+2H2O(g)=2H2(g)+2CO2(g)△H=-566kJ?moL-1-(-483.6KJ?moL-1)=-82.4KJ?moL-1.
即CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ?moL-1.
故答案为:CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ?moL-1;
②令参加反应的CO的物质的量为nmol,则:
CO(g)+H2O(g)=H2(g)+CO2(g)
开始(mol):1 1 0 0
变化(mol):n n n n
平衡(mol):1-n 1-n n n
所以
| n×n |
| (1-n)×(1-n) |
| 0.5mol |
| 1mol |
由①可知该反应正反应是放热反应,升高温度平衡向逆反应移动,
故答案为:50%;逆;
③A.增大的CO浓度,平衡向正反应移动,但CO的转化率降低,故A错误;
B.增大的H2O(g)浓度,平衡向正反应移动,但CO的转化率增大,故B正确;
C.使用催化剂加快反应速率,平衡不移动,CO转化率不变,故C错误;
D.降低温度平衡向正反应移动,但CO的转化率增大,故D正确.
故答案为:BD;
(3)原电池负极发生氧化反应,氢气在负极放电,在碱性条件下,氢气放电生成水,负极电极反应式为H2-2e-+2OH-═2H2O,
故答案为:H2-2e-+2OH-═2H2O.
点评:本题考查燃烧热概念、热化学方程式书写与计算、化学平衡移动与计算、平衡常数、原电池等,是对知识的综合应用,题目难度中等,注意理解把握燃烧热的概念和三段式在化学平衡计算中的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在体积相同的A、B两个带活塞的玻璃容器中,分别注入
体积颜色相同的NO2与溴蒸气,然后将活塞同时向外拉出到
(快速),过一会可以看到( )
| 1 |
| 4 |
| 1 |
| 2 |
| A、A中的颜色比B中的浅 |
| B、A中的颜色比B中的深 |
| C、A中的颜色与B中的深浅相同 |
| D、A中颜色比开始时深 |
“活化分子”是衡量化学反应速率快慢的重要依据,下列有关说法不正确的是( )
| A、能够发生有效碰撞的分子一定是活化分子 |
| B、增大浓度,单位体积内活化分子数增加,化学反应速率增大 |
| C、加入反应物,使活化分子百分数增大,化学反应速率增大 |
| D、一般使用催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率 |
化学与生活密切相关.下列情况会对人体健康造成较大危害的是( )
| A、用Cl2对自来水进行消毒杀菌 |
| B、用SO2漂白食品 |
| C、用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) |
| D、用小苏打(NaHCO3)发酵面团制作馒头 |
关于下列各装置图的叙述不正确的是( )


| A、用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 |
| B、图②装置的盐桥中KCl的Cl-移向甲烧杯 |
| C、图③装置中钢闸门应与外接电源的负极相连获得保护 |
| D、装置④中Ag电极发生反应:2H2O+2e-=H2↑+2OH- |
下列事实可以得出最后结论的是( )
| A、常温下,反应:C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H<0 | ||
B、一定温度下,反应:MgO(l)═Mg(l)+
| ||
| C、CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | ||
| D、已知反应:C(s)+H2O(g)→CO(g)+H2(g)△H=+131.4kJ,该反应在常温下一定可自发进行 |
 中学化学中几种常见物质的转化关系如图所示:
中学化学中几种常见物质的转化关系如图所示: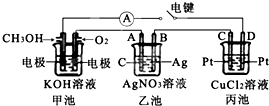 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题: