题目内容
pH、体积都相同的醋酸和硫酸,分别跟足量的碳酸钠溶液反应,在相同条件下,放出二氧化碳气体的体积是( )
| A、醋酸多 | B、硫酸多 |
| C、一样多 | D、无法比较 |
考点:pH的简单计算,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:醋酸为弱电解质,溶液中部分电离出氢离子,pH、溶液体积相同时,醋酸中含有的氢离子的物质的量大于硫酸;产生与碳酸钠溶液反应生成的二氧化体积大于硫酸.
解答:
解:氢离子与碳酸钠反应生成CO2的离子反应为:CO32-+2H+=CO2↑+H2O,产生的CO2的体积与H+的物质的量有关,
pH相等体积也相等的盐酸和醋酸已经电离的n(H+)是相等的,但随着CO2的不断生成,醋酸还能继续电离出H+,而盐酸不会增加H+,
故当碳酸钠溶液足量时,醋酸产生的CO2肯定多,
故选A.
pH相等体积也相等的盐酸和醋酸已经电离的n(H+)是相等的,但随着CO2的不断生成,醋酸还能继续电离出H+,而盐酸不会增加H+,
故当碳酸钠溶液足量时,醋酸产生的CO2肯定多,
故选A.
点评:本题考查了弱电解质的电离、溶液pH与溶液酸碱性的关系,题目难度中等,注意明确弱电解质的电离平衡、溶液酸碱性与溶液pH的关系,试题侧重考查学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
“活化分子”是衡量化学反应速率快慢的重要依据,下列有关说法不正确的是( )
| A、能够发生有效碰撞的分子一定是活化分子 |
| B、增大浓度,单位体积内活化分子数增加,化学反应速率增大 |
| C、加入反应物,使活化分子百分数增大,化学反应速率增大 |
| D、一般使用催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率 |
化学与生活密切相关.下列情况会对人体健康造成较大危害的是( )
| A、用Cl2对自来水进行消毒杀菌 |
| B、用SO2漂白食品 |
| C、用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) |
| D、用小苏打(NaHCO3)发酵面团制作馒头 |
关于下列各装置图的叙述不正确的是( )


| A、用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 |
| B、图②装置的盐桥中KCl的Cl-移向甲烧杯 |
| C、图③装置中钢闸门应与外接电源的负极相连获得保护 |
| D、装置④中Ag电极发生反应:2H2O+2e-=H2↑+2OH- |
下列热化学方程式正确的是( )
| A、甲烷的燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 | |||
| B、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为 N2(g)+3H2(g)
| |||
C、已知在101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+
| |||
| D、25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ?mol-1,硫酸溶液与氢氧化钾溶液反应的中和热的热化学方程式为H2SO4(aq)+2KOH(aq)═K2SO4(aq)+2H2O(l)△H=-114.6 kJ?mol-1 |
下列事实可以得出最后结论的是( )
| A、常温下,反应:C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H<0 | ||
B、一定温度下,反应:MgO(l)═Mg(l)+
| ||
| C、CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | ||
| D、已知反应:C(s)+H2O(g)→CO(g)+H2(g)△H=+131.4kJ,该反应在常温下一定可自发进行 |
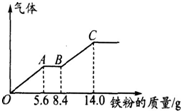 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A、H2SO4浓度为2.5 mol?L-1 |
| B、第二份溶液中最终溶质为FeSO4 |
| C、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 |
| D、原混合酸中NO3-物质的量为0.1mol |
下列有关化学用语使用正确的是( )
A、HClO的电子式:H:
| ||||||||
B、具有16个质子、16个中子和18个电子的微粒是
| ||||||||
C、邻羟基苯甲酸的结构简式: | ||||||||
D、乙烯的比例模型: |
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,工业上合成氨反应通常用铁触媒作催化剂,反应方程式为:N2+3H2?2NH3△H<0.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,工业上合成氨反应通常用铁触媒作催化剂,反应方程式为:N2+3H2?2NH3△H<0.