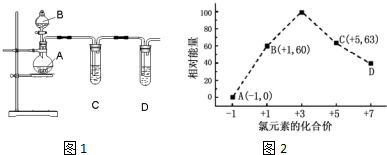
题目内容
14.某学生设计的用浓盐酸与二氧化锰反应制取并收集干燥的纯净的氯气的装置图: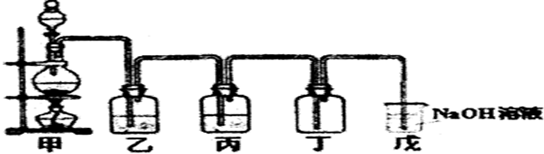
(1)甲中发生的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2+2H2O
(2)乙中盛的试剂饱和食盐水、作用除去氯化氢;丙中盛的试剂浓硫酸;
(3)若将制得的少量氯气通入无色的饱和碘化钾溶液中,溶液变棕黄色,其化学方程式是Cl2+2KI=2KCl+I2,向所得溶液中加入四氯化碳,振荡后静置,则溶液分为两层,下层显紫红色,此反应可证明氧化性:氯气大于碘单质.(填“大于”或“等于”或“小于”)(4)氯气是有毒气体,因此上图装置中戊(填“甲”或“乙”或“丙”或“丁”或“戊”)装置可起到尾气吸收处理,其原理用化学方程式解释Cl2+2NaOH=NaCl+NaClO+H2O.
分析 甲是气体的发生装置,二氧化锰与浓盐酸加热产生氯气,氯气中含有氯化氢和水蒸气,在气体的净化过程中,最后除掉水,所以通过乙装置的洗气瓶除去杂质氯化氢,丙装置除掉水,丁装置是收集装置,氯气密度比空气大,导管应长进短出,氯气有毒必须进行尾气处理,据此分析.
(1)二氧化锰与浓盐酸在加热条件下反应生成氯气和氯化锰、水;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢和水蒸气,通过盛有饱和食盐水的洗气瓶可以除去氯化氢,通过盛有浓硫酸的洗气瓶可以除去水蒸气;
(3)氯气的氧化性强于碘,氯气与碘化钾反应生成碘,碘溶于水得到棕黄色的碘水溶液,碘在水中溶解度小于在有机物中的溶解度,四氯化碳密度大于水的密度;
(4)氯气有毒,可用碱液吸收,用装置戊进行尾气处理.
解答 解:甲是气体的发生装置,二氧化锰与浓盐酸加热产生氯气,氯气中含有氯化氢和水蒸气,在气体的净化过程中,最后除掉水,所以通过乙装置的洗气瓶除去杂质氯化氢,丙装置除掉水,丁装置是收集装置,氯气密度比空气大,导管应长进短出,氯气有毒必须进行尾气处理.
(1)二氧化锰与浓盐酸在加热条件下反应生成氯气和氯化锰、水,离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2+2H2O;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢和水蒸气,氯化氢极易溶于水,氯气难溶于饱和食盐水,浓硫酸具有吸水性,通过盛有饱和食盐水的洗气瓶可以除去氯化氢,通过盛有浓硫酸的洗气瓶可以除去水蒸气,
故答案为:饱和NaCl溶液;除去Cl2中混有的HCl气体;浓硫酸;
(3)氯气与碘化钾反应生成碘,化学方程式为:Cl2+2KI=2KCl+I2,碘水呈棕黄色,碘在四氯化碳中的溶解度大于在水中的溶解度,四氯化碳的密度大于水,所以所得溶液中加入四氯化碳,振荡后静置,则溶液分为两层,下层溶解碘的四氯化碳层为紫红色,上层为水层,根据强制弱原理可得氯气的氧化性大于碘单质,
故答案为:棕黄;Cl2+2KI=2KCl+I2;紫红;大于;
(4)氯气有毒,可用碱液吸收,用装置戊进行尾气处理,反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:戊;Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查了氯气的制备和性质的检验,及实验方案的设计,明确制备原理和氯气及氯水的性质是解题关键,题目难度不大.

| A. | 两极附近颜色无明显变化 | B. | 两极产生等量气体 | ||
| C. | 阳极附近的颜色变红 | D. | 阴极附近的颜色变红 |
①Fe+Cu2+═Fe2++Cu
②Al3++3NH3•H2O═Al(OH)3↓+3NH4+
③Cl2+H2O?H++Cl-+HClO
④CaCO3+2H+═Ca2++CO2↑+H2O
⑤Ag++Cl-═AgCl↓
| A. | ③⑤ | B. | ②③ | C. | 只有③ | D. | ①④ |
| A. | 称量的NaOH固体已经潮解 | |
| B. | 洗涤后的容量瓶中留有少量蒸馏水 | |
| C. | 转移溶解液时,溶解液未冷却至室温 | |
| D. | 定容时俯视容量瓶的刻度线 |
| A. | 无色溶液:Ca2+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 水电离出的c(H+)=10-13mol•L-1的溶液中:K+、Na+、SO42-、AlO2- | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
| A. | 合金材料中可能含有非金属元素 | |
| B. | 燃烧化石燃料排放的废气中含大量CO2、SO2造成大气污染,使雨水pH=5.6,形成酸雨 | |
| C. | 废弃的玻璃、金属、纸制品是可回收利用的资源 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
| A. | Cl2O7、P2O5、SO3、CO2、NO2均属于酸性氧化物 | |
| B. | K2O、K2O2、KO2为相同元素组成的金属氧化物,都属于碱性氧化物 | |
| C. | 根据能否发生丁达尔效应,可以区分胶体和溶液 | |
| D. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |