题目内容
4.一定温度下,反应N2(g)+O2(g)?2NO(g)在密闭容器中进行,回答下列措施对化学反应速率的影响.(填“增大”、“减小”或“不变”)(1)缩小体积使压强增大:增大;
(2)恒容充入N2:增大;
(3)恒容充入He:不变;
(4)恒压充入He:减小.
分析 增大压强、增大反应物浓度、升高温度、加入催化剂都能加快反应速率,据此分析解答.
解答 解:(1)缩小体积使压强增大,增大单位体积内活化分子个数,则反应速率增大,
故答案为:增大;
(2)恒容充入N2,氮气浓度增大,增大单位体积内活化分子个数,化学反应速率增大,故答案为:增大; (3)恒容充入He,但参加反应的气体浓度不变,则化学反应速率不变,故答案为:不变;
(4)恒压充入He,容器体积增大,导致参加反应的气体浓度减小,则化学反应降低,故答案为:减小.
点评 本题考查化学反应速率影响因素,为高频考点,明确浓度、压强对化学反应速率影响原理是解本题关键,注意:只有压强改变能引起反应物或生成物浓度改变的才能改变反应速率,否则不改变反应速率,易错点是(3)的分析,题目难度不大.

练习册系列答案
相关题目
15.在密闭容器中发生反应:X2(g)+3Y2(g)?2Z(g),其中X2、Y2、Z的起始浓度依次为0.3mol•L-1、0.3mol•L-1、0.2mol•L-1,当反应达到平衡时,各物质的浓度有可能的是( )
| A. | c(X2)=0.1mol•L-1 | B. | c(Y2)=0.3mol•L-1 | C. | c(X2)=0.2mol•L-1 | D. | c(Z)=0.3mol•L-1 |
12.能正确表示下列反应的离子方程式的是( )
| A. | 向FeI2溶液中加入少量氯水2Fe2++Cl2=2Fe3++2Cl- | |
| B. | NaClO (aq) 中通入过量 SO2:C1O-+SO2+H2O=HClO+HSO3- | |
| C. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2 HClO |
9.下列有关实验用品的使用或操作的叙述中,正确的是( )
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 分液时,上层液体从分液漏斗下口流出 | |
| C. | 在制取蒸馏水的实验中收集冷凝水时,应弃去开始蒸馏出的部分 | |
| D. | 在制取蒸馏水的实验中,冷水从冷凝管上口入,下口出 |
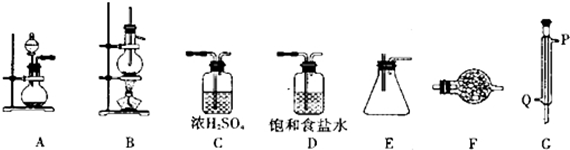
11.某化学研究性学习小组拟利用下列装置和药品进行四氯化锡的制备.供选择的药品:4.8gSn、浓HCl、稀HCl、浓H2SO4、MnO2、KMnO4、无水CaCl2、碱石灰.
仪器装置:
已知四氯化锡具有强的吸水性,水解生成锡的氧化物.SnCl4和Sn的部分数据如下:
请回答下列相关问题:
(1)实验时装置的正确连接顺序为A→D→C→B→G→E→F
(2)仪器G的名称是冷凝管实验时,冷却水的流向是从Q进入(填符号)
(3)A中反应的离子方程式2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(4)F中盛装的化学试剂是碱石灰;作用是防止空气中的水分进入装置E中、吸收多余的Cl2防止污染.写出SnCl4水解的化学方程式SnCl4+4H2O=Sn(OH)4+4HCl.
(5)实验完毕后,E装置质量增加9.4g,SnCl4的产率是90%.
仪器装置:

已知四氯化锡具有强的吸水性,水解生成锡的氧化物.SnCl4和Sn的部分数据如下:
| 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | |
| 四氯化锡 | 2.2 | -33 | 114 |
| 金属锡 | 5.77 | 231 |
(1)实验时装置的正确连接顺序为A→D→C→B→G→E→F
(2)仪器G的名称是冷凝管实验时,冷却水的流向是从Q进入(填符号)
(3)A中反应的离子方程式2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(4)F中盛装的化学试剂是碱石灰;作用是防止空气中的水分进入装置E中、吸收多余的Cl2防止污染.写出SnCl4水解的化学方程式SnCl4+4H2O=Sn(OH)4+4HCl.
(5)实验完毕后,E装置质量增加9.4g,SnCl4的产率是90%.
12.煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:
(1)NaClO2的化学名称为亚氯酸钠.
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol•L-1.反应一段时间后溶液中离子浓度的分析结果如下表.
①写出NaClO2溶液脱硝过程中主要反应的离子方程式3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O.增加压强,NO的转化率提高(填“提高”、“不变”或“降低”).
②随着吸收反应的进行,吸收剂溶液的pH逐渐减小(填“增大”“不变”或“减小”).
③由实验结果可知,脱硫反应速率脱硝反应速率大于(填“大于”或“小于”).原因是除了SO2和NO在烟气中的初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高.
(1)NaClO2的化学名称为亚氯酸钠.
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol•L-1.反应一段时间后溶液中离子浓度的分析结果如下表.
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
②随着吸收反应的进行,吸收剂溶液的pH逐渐减小(填“增大”“不变”或“减小”).
③由实验结果可知,脱硫反应速率脱硝反应速率大于(填“大于”或“小于”).原因是除了SO2和NO在烟气中的初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高.
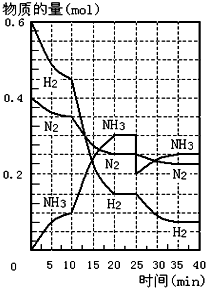 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,根据题意完成下列各题:
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,根据题意完成下列各题: