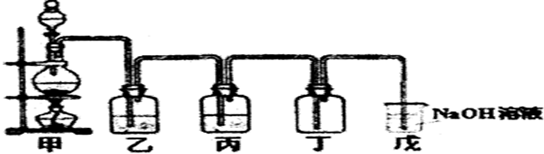
题目内容
2.配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的是( )| A. | 称量的NaOH固体已经潮解 | |
| B. | 洗涤后的容量瓶中留有少量蒸馏水 | |
| C. | 转移溶解液时,溶解液未冷却至室温 | |
| D. | 定容时俯视容量瓶的刻度线 |
分析 结合c=$\frac{n}{V}$及不当操作对n、V的影响分析物质的量浓度,若n偏小,则c偏小;若V偏大,则c偏小,以此来解答.
解答 解:A.称量的NaOH固体已经潮解,NaOH的质量偏小,n偏小,可知c偏低,故A选;
B.洗涤后的容量瓶中留有少量蒸馏水,对溶液配制实验无影响,故B不选;
C.转移溶解液时,溶解液未冷却至室温,加水定容后,V偏小,可知c偏高,故C不选;
D.定容时俯视容量瓶的刻度线,V偏小,可知c偏高,故D不选;
故选A.
点评 本题考查配制一定物质的量浓度的溶液,为高频考点,把握物质的量、浓度、体积为解答的关键,侧重分析与应用能力的考查,注意误差分析的判断,题目难度不大.

练习册系列答案
相关题目
12.下列图①~④分别与相应的操作过程相对应,其中正确的是( )
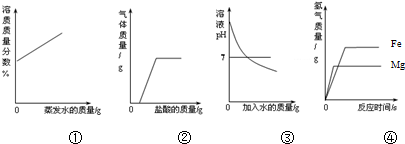

| A. | ①在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分 | |
| B. | ②向露置在空气中部分变质的氢氧化钠溶液中加入稀盐酸 | |
| C. | ③向氢氧化钠溶液中不断加水稀释 | |
| D. | ④相同质量的且过量的镁粉和铁粉,分别与质量和质量分数相同的稀盐酸反应 |
13.由实验事实得出的结论,其中正确的是( )
| 实验事实 | 结论 | |
| A | Cl2的水溶液能导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | 金属钠与乙醇反应不如钠与水反应剧烈 | 乙醇分子中的羟基氢原子不如水分子中的氢原子活泼 |
| D | 加热煮沸滴有石蕊试液的SO2水溶液,红色褪去 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
7.能正确表示下列反应的离子方程式为( )
| A. | 碳酸氢钠溶液中滴入足量氢氧化钙溶液:HCO3-+OH-=CO32-+H2O | |
| B. | 硅酸钠溶液与足量CO2反应:SiO32-+CO2+H2O=H2SiO3↓+CO32- | |
| C. | FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-=2AlO2-+H2O |
11.下列物质由离子构成的是( )
| A. | 铜 | B. | 二氧化碳 | C. | 金刚石 | D. | 氯化钠 |
12.能正确表示下列反应的离子方程式的是( )
| A. | 向FeI2溶液中加入少量氯水2Fe2++Cl2=2Fe3++2Cl- | |
| B. | NaClO (aq) 中通入过量 SO2:C1O-+SO2+H2O=HClO+HSO3- | |
| C. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2 HClO |
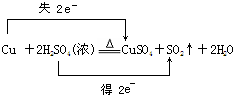 .
.