题目内容
4.在硫酸工业里,焙烧硫铁矿(FeS2)制取SO2的反应为4FeS2+11O2═2Fe2O3+8SO2.下列有关说法不正确的是( )| A. | FeS2作还原剂,铁元素被还原 | |
| B. | Fe2O3和SO2都既是氧化产物又是还原产物 | |
| C. | 每生成1 mol Fe2O3,有4mol硫被氧化 | |
| D. | 每1 mol硫被氧化,转移电子5.5mol |
分析 4FeS2+11O2=2Fe2O3+8SO2中,Fe、S元素的化合价升高,O元素的化合价降低,以此来解答.
解答 解:A.Fe元素的化合价升高,铁元素被氧化,故A错误;
B.Fe、S元素的化合价升高,O元素的化合价降低,则Fe2O3和SO2都既是氧化产物又是还原产物,故B正确;
C.由方程式可知,生成2molFe2O3,有4molFeS2参加反应,8molS被氧化,则每生成1 mol Fe2O3,有4mol硫被氧化,故C正确;
D.4mol FeS2发生反应时,8molS被氧化,11mol氧气得到电子,反应中共有11mol×2×2=44mol电子转移,则每1 mol硫被氧化,转移电子5.5mol,故D正确.
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
19.对于反应8NH3+3Cl2═N2+6NH4Cl,下列说法正确的是( )
| A. | N2是还原产物,且还原剂与氧化剂物质的量之比是2:3 | |
| B. | N2是氧化产物,且还原剂与氧化剂物质的量之比是2:3 | |
| C. | 每转移6mol电子就生成22.4LN2 | |
| D. | NH4Cl是氧化产物,且还原剂与氧化剂物质的量之比是2:3 |
15. 一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,
发生如下反应:CO(g)+H2O (g)═CO2(g) 十 H2 (g);△H<0
(1)在850℃时,CO和H2O浓度变化如图,则 0~4min的平均反应速率v(CO2)=0.03mol•L-1•min-1
(2)t1℃时,在相同容器中发生上述反应,各物质的浓度变化如表:
计算t1℃该反应的平衡常数K=0.5.
(3)t2℃时,化学反应CO (g)+H2O (g)?CO2(g)+H2 (g)的平衡浓度符合c(CO2)•c(H2)═2c(CO)•c(H2O),则t2℃<850℃,判断依据是:t2℃的平衡常数为2,大于850℃的平衡常数1,平衡右移
(4)在t1℃达平衡时,又充入CO,再次平衡时,混合气体中H2O的体积分数将减小(填“增大”、“减小”或“无法确定”) H2O的转化率将增大(填“增大”、“减小”或“无法确定”)
(5))判断该反应达到化学平衡状态的依据是AB(填序号):
A.V(正)(CO)=V (逆)(CO2)
B.CO消耗速率等于H2的消耗速率
C. 容器内压强保持不变
D.混合气体的密度保持不变
E.容器中气体的平均相对分子质量不随时间而变化
F.混合气体的质量保持不变.
 一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO(g)+H2O (g)═CO2(g) 十 H2 (g);△H<0
(1)在850℃时,CO和H2O浓度变化如图,则 0~4min的平均反应速率v(CO2)=0.03mol•L-1•min-1
(2)t1℃时,在相同容器中发生上述反应,各物质的浓度变化如表:
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
(3)t2℃时,化学反应CO (g)+H2O (g)?CO2(g)+H2 (g)的平衡浓度符合c(CO2)•c(H2)═2c(CO)•c(H2O),则t2℃<850℃,判断依据是:t2℃的平衡常数为2,大于850℃的平衡常数1,平衡右移
(4)在t1℃达平衡时,又充入CO,再次平衡时,混合气体中H2O的体积分数将减小(填“增大”、“减小”或“无法确定”) H2O的转化率将增大(填“增大”、“减小”或“无法确定”)
(5))判断该反应达到化学平衡状态的依据是AB(填序号):
A.V(正)(CO)=V (逆)(CO2)
B.CO消耗速率等于H2的消耗速率
C. 容器内压强保持不变
D.混合气体的密度保持不变
E.容器中气体的平均相对分子质量不随时间而变化
F.混合气体的质量保持不变.
12.下列由实验现象得出的结论正确的是:( )
| 选项 | 操作及现象 | 结论 |
| A | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | 溶液中含有NH4+ |
| B | 将浓硝酸滴入碳酸钠溶液中,然后将生成的气体直接通入硅酸钠溶液中,溶液变浑浊. | 酸性:硝酸>碳酸>硅酸 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,溶液变成蓝色 | 氧化性:I2>Cl2 |
| D | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| A. | A | B. | B | C. | C | D. | D |
19. 铜锌原电池(如图)工作时,以下说法正确的是( )
铜锌原电池(如图)工作时,以下说法正确的是( )
①电子流动方向从Zn-灯泡-Cu-盐桥;②Zn电极的质量减轻Cu电极的质量增重;③盐桥中的K+移向CuSO4溶液;④将锌片浸入硫酸铜溶液发生的化学反应与该电池反应相同为:Zn+Cu2+═Zn2++Cu;⑤Zn电极失电子发生还原反应.
 铜锌原电池(如图)工作时,以下说法正确的是( )
铜锌原电池(如图)工作时,以下说法正确的是( )①电子流动方向从Zn-灯泡-Cu-盐桥;②Zn电极的质量减轻Cu电极的质量增重;③盐桥中的K+移向CuSO4溶液;④将锌片浸入硫酸铜溶液发生的化学反应与该电池反应相同为:Zn+Cu2+═Zn2++Cu;⑤Zn电极失电子发生还原反应.
| A. | ①②③ | B. | ②④⑤ | C. | ②③④ | D. | ③④⑤ |
9.X、Y、Z、W、R均为第3周期主族元素,且原子序数依次增大.X、Y、W的最高价氧化物对应水化物两两之间都能发生反应,Z的单质常用作半导体.下列说法错误的是( )
| A. | X的两种氧化物中阴阳个数比均为1:2 | |
| B. | Y的氧化物熔点高,常用作耐高温材料 | |
| C. | Z的氧化物属于酸性氧化物,不能与任何酸反应 | |
| D. | R的同主族氢化物稳定性从上往下依次减弱 |
14.下列理解正确的是( )
| A. | 摩尔是国际单位制中七个基本物理量之一 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,0.012 kg碳原子中所含有的碳原子数目为1摩 |
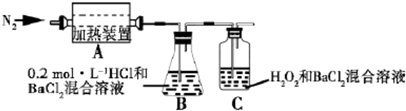
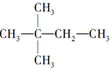 ,则A的结构简式为(CH3)3CCH=CH2.
,则A的结构简式为(CH3)3CCH=CH2.