��Ŀ����
 ��ҵ�ϡ��̶���������CO2����Ч�ؼ��ᡰ���ҡ�ЧӦ����һ����CO2�����״�ȼ�ϵķ�����CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ?mol-1
��ҵ�ϡ��̶���������CO2����Ч�ؼ��ᡰ���ҡ�ЧӦ����һ����CO2�����״�ȼ�ϵķ�����CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ?mol-1��1������ͬ�¶Ⱥ��ݻ�����ʱ����˵���÷�Ӧ�Ѵ�ƽ��״̬����
A��n��CO2����n��H2����n��CH3OH����n��H2O��=1��3��1��1
B��������ѹǿ���ֲ���
C��H2������������CH3OH����������֮��Ϊ1��3
D�������ڵ��ܶȱ��ֲ���
E��������CO2���������ֲ���
F�������ڵ�ƽ����Է��������ֲ���
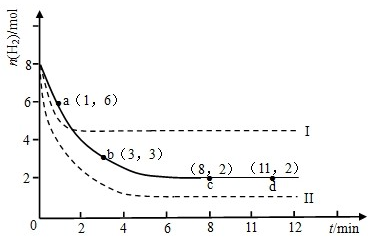
��2��ij��ѧʵ�齫6molCO2��8molH2����2L���ܱ������У����H2�����ʵ�����ʱ��仯��ͼ��ʾ��ʵ�ߣ���
��a������Ӧ����
�ڽ��ı�ijһʵ�������ٽ�������ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ��������ʾ������I��Ӧ��ʵ�������ı���
�ۼ���ӷ�Ӧ��ʼ��1���ӣ�CO2�ķ�Ӧƽ�����ʣ���д��������̣�
����ƽ��ʱ������ת���ʺ������·�Ӧ��ƽ�ⳣ��K����д��������̣�
���㣺��ѧƽ��ļ���,��ѧƽ���Ӱ������,��ѧƽ��״̬���ж�
ר�⣺��ѧƽ��ר��
��������1�����淴Ӧ�ﵽƽ��״̬��һ���������淴Ӧ������ȣ�����ֵ�Ũ�ȡ��ٷֺ������ٱ仯���ݴ˽����жϣ�
��2���ٸ���ͼ�������������ʵ����仯�жϷ�Ӧ���еķ���Ȼ���ж����淴Ӧ���ʴ�С��
�����ߢ�ķ�Ӧ���ʴ���ԭ��Ӧ���ﵽƽ��ʱ���������ʵ�������˵��ƽ�����������ƶ������ߢ�ķ�Ӧ���ʴ���ԭ��Ӧ���ﵽƽ��ʱ���������ʵ�����С��˵��ƽ�����������ƶ���
�۸���v=
���������ķ�Ӧ���ʣ���ϸ������ʱ�ʾ������֮�ȵ���ϵ��֮�������㣮
�ܸ���ͼ����ʵ�������жϴﵽƽ��״̬ʱ���������ʵ��������������Ũ�ȼ�Ũ�ȱ仯����������ʽ��ʽ���������ֵ�Ũ�ȣ�������ƽ�ⳣ������ʽ������÷�Ӧ��ƽ�ⳣ����
��2���ٸ���ͼ�������������ʵ����仯�жϷ�Ӧ���еķ���Ȼ���ж����淴Ӧ���ʴ�С��
�����ߢ�ķ�Ӧ���ʴ���ԭ��Ӧ���ﵽƽ��ʱ���������ʵ�������˵��ƽ�����������ƶ������ߢ�ķ�Ӧ���ʴ���ԭ��Ӧ���ﵽƽ��ʱ���������ʵ�����С��˵��ƽ�����������ƶ���
�۸���v=
| ��c |
| ��t |
�ܸ���ͼ����ʵ�������жϴﵽƽ��״̬ʱ���������ʵ��������������Ũ�ȼ�Ũ�ȱ仯����������ʽ��ʽ���������ֵ�Ũ�ȣ�������ƽ�ⳣ������ʽ������÷�Ӧ��ƽ�ⳣ����
���
�⣺��1��A��n��CO2����n��H2����n��CH3OH����n��H2O��=1��3��1��1�������ж����淴Ӧ�����Ƿ���ȣ����ж��Ƿ�ﵽƽ��״̬����A����
B���÷�Ӧ�������С�ķ�Ӧ��������ѹǿ���ֲ��䣬�������淴Ӧ������ȣ�����ֵ�Ũ�Ȳ��ٱ仯���ﵽ��ƽ��״̬����B��ȷ��
C����H2������������CH3OH����������֮��Ϊ3��1ʱ���ܱ�ʾ���淴Ӧ���ʣ��������������ϵ��˵���ﵽ��ƽ��״̬����C����
D�������ڵ��ܶȱ��ֲ��䣬��Ӧ����ʽ���߶������壬��������������䣬�������ݻ��̶������Է�Ӧ������������ܶ�ʼ�ղ��䣬�����ܶȲ�����Ϊ�ж�ƽ��״̬�����ݣ���D����
E��������CO2���������ֲ��䣬��Ũ�Ȳ�˯ʱ��仯���仯���ﵽ��ƽ�⣬��E��ȷ��
F�������ڵ�ƽ����Է������������������ʵ����ı�ֵ�������غ㣬����n�仯�����Ե�ƽ����Է��������ֲ��䣬�ﵽ��ƽ�⣬��F��ȷ��
��ѡBEF��
��2���ٸ���ͼ���֪��a��b���������������ʵ�����С��˵����Ӧ���������ƶ�������Ӧ���ʴ����淴Ӧ���ʣ��ʴ�Ϊ�����ڣ�
�������ߢ�ķ�Ӧ���������Ҵﵽƽ��ʱ���������ʵ�������ƽ�����������ƶ����÷�ӦΪ���ȷ�Ӧ��˵���������¶ȣ����淴Ӧ���ʶ�����ƽ�����������ƶ���������ת���ʼ�С��
�������ߢ�����߿�֪����Ӧ���ʱ�ԭ��Ӧ���ﵽƽ��ʱ���������ʵ�����С��ƽ�����������ƶ����÷�Ӧ�������С�ķ�Ӧ��˵��������ѹǿ�����淴Ӧ���ʶ�����ƽ�����������ƶ���������ת��������
�ʴ�Ϊ�������¶ȣ�����ѹǿ��
�۴ӷ�Ӧ��ʼ��1���ӣ�H2�ķ�Ӧƽ������=
=1mol?��L?min��-1�����ʱ�ʾ������֮�ȵ���ϵ��֮�ȣ�����CO2�ķ�Ӧƽ������=
v��H2��=0.33 mol?��L?min��-1��
�𣺴ӷ�Ӧ��ʼ��1���ӣ�CO2�ķ�Ӧƽ������0.33 mol?��L?min��-1��
��CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ���ʵ���/mol 6 8 0 0
���ʵ����仯/mol 2 6 2 2
ƽ�����ʵ���/mol 4 2 2 2
H2��ת����=n��H2������n��H2����ʼ��100%�T
��100%=75%��
K=
=
=0.5L-2/mol-2��
��ƽ��ʱ������ת����Ϊ75%���������·�Ӧ��ƽ�ⳣ��K=0.5L-2/mol-2��
B���÷�Ӧ�������С�ķ�Ӧ��������ѹǿ���ֲ��䣬�������淴Ӧ������ȣ�����ֵ�Ũ�Ȳ��ٱ仯���ﵽ��ƽ��״̬����B��ȷ��
C����H2������������CH3OH����������֮��Ϊ3��1ʱ���ܱ�ʾ���淴Ӧ���ʣ��������������ϵ��˵���ﵽ��ƽ��״̬����C����
D�������ڵ��ܶȱ��ֲ��䣬��Ӧ����ʽ���߶������壬��������������䣬�������ݻ��̶������Է�Ӧ������������ܶ�ʼ�ղ��䣬�����ܶȲ�����Ϊ�ж�ƽ��״̬�����ݣ���D����
E��������CO2���������ֲ��䣬��Ũ�Ȳ�˯ʱ��仯���仯���ﵽ��ƽ�⣬��E��ȷ��
F�������ڵ�ƽ����Է������������������ʵ����ı�ֵ�������غ㣬����n�仯�����Ե�ƽ����Է��������ֲ��䣬�ﵽ��ƽ�⣬��F��ȷ��
��ѡBEF��
��2���ٸ���ͼ���֪��a��b���������������ʵ�����С��˵����Ӧ���������ƶ�������Ӧ���ʴ����淴Ӧ���ʣ��ʴ�Ϊ�����ڣ�
�������ߢ�ķ�Ӧ���������Ҵﵽƽ��ʱ���������ʵ�������ƽ�����������ƶ����÷�ӦΪ���ȷ�Ӧ��˵���������¶ȣ����淴Ӧ���ʶ�����ƽ�����������ƶ���������ת���ʼ�С��
�������ߢ�����߿�֪����Ӧ���ʱ�ԭ��Ӧ���ﵽƽ��ʱ���������ʵ�����С��ƽ�����������ƶ����÷�Ӧ�������С�ķ�Ӧ��˵��������ѹǿ�����淴Ӧ���ʶ�����ƽ�����������ƶ���������ת��������
�ʴ�Ϊ�������¶ȣ�����ѹǿ��
�۴ӷ�Ӧ��ʼ��1���ӣ�H2�ķ�Ӧƽ������=
| ||
| 1min |
| 1 |
| 3 |
�𣺴ӷ�Ӧ��ʼ��1���ӣ�CO2�ķ�Ӧƽ������0.33 mol?��L?min��-1��
��CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ���ʵ���/mol 6 8 0 0
���ʵ����仯/mol 2 6 2 2
ƽ�����ʵ���/mol 4 2 2 2
H2��ת����=n��H2������n��H2����ʼ��100%�T
| 6 |
| 8 |
K=
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| ||||
|
��ƽ��ʱ������ת����Ϊ75%���������·�Ӧ��ƽ�ⳣ��K=0.5L-2/mol-2��
���������⿼���˻�ѧƽ��״̬���жϡ�ԭ��ص缫��Ӧʽ��д����ѧƽ��ļ����֪ʶ����Ŀ�ѶȽϴ��漰��֪ʶ��϶࣬��ֿ�����ѧ������д֪ʶ�����������

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
��������Һ��ˮϡ�ͣ���Һ��ÿ�����ӵ�Ũ�ȶ��������ӵ��ǣ�������
| A��CH3COOH��Һ |
| B��NaCl��Һ |
| C��NaOH��Һ |
| D��FeCl3��Һ |
pH=1��1L H2SO4 ��Һ��0.1mol ��Na2CO3��ϣ���ַ�Ӧ������Һ�м���28g ��BaCl2?xH2O��Ba2+ǡ����ȫ��������x��ֵ�ǣ�������
| A��2 | B��4 | C��6 | D��8 |
�����з��ţ�35Cl��37Cl��O2��O3��1H216O��2H218O�������й�˵����ȷ���ǣ�������
| A��35��37��ʾ���������� |
| B��35Cl��37Cl����Ϊͬ�������� |
| C��O2��O3����Ԫ�ص�����ͬλ�� |
| D��1H216O��2H218O����Է���������ͬ |
 ������������AG��ʾ��Һ����ȣ�AG�Ķ���Ϊ��AG=lg
������������AG��ʾ��Һ����ȣ�AG�Ķ���Ϊ��AG=lg| c(H+) |
| c(OH-) |
| A��A��ʱ��������������Һ���Ϊ20 mL |
| B������ʱ0.01 mol?L-1�Ĵ�����ҺpH=4 |
| C��OA����Һ�У�c��CH3COO-����c��CH3COOH�� |
| D����B��ʱ����NaOH��Һ40 mL��������Һ�У�c��CH3COO-��+2 c��CH3COOH��=c��OH-��-c��H+�� |
 ���������ʵ���г�������������KMnO4��Һ�����Ի���������·ֽ��ٶȽ���������������ˮ��Һ�ȶ��Խϲ�ж������̺���������������ֽ����ʼӿ죮
���������ʵ���г�������������KMnO4��Һ�����Ի���������·ֽ��ٶȽ���������������ˮ��Һ�ȶ��Խϲ�ж������̺���������������ֽ����ʼӿ죮