题目内容
石油裂化可得到汽油和石化工业的基础原料.A是石油裂化产物样品.
(1)A是一种烷烃,相对分子质量为114,则A的分子式为 .
假设汽油的成分就是A,空气中氧气的体积占五分之一,汽车内燃机中A与空气混合,用电火花不断引爆,燃烧产物全是气体.
空气与A的体积比为a,为使A充分燃烧,a的最小值为 .
若a值偏小,则汽车尾气中增多的污染气体的化学式为 ,当a值减小10%时,尾气中产生该污染气体的体积分数为 .
若a值偏大,汽车尾气中增多的污染气体总称为 .
(2)B为乙烯、乙炔和氢气的混合气体,测得其在标准状况下的密度为0.478g/L,使该混合气体在加热的条件下通过镍催化剂并充分反应,再冷却到标准状况下测其密度为1.062g/L,试求出B中各气体的体积分数.
(1)A是一种烷烃,相对分子质量为114,则A的分子式为
假设汽油的成分就是A,空气中氧气的体积占五分之一,汽车内燃机中A与空气混合,用电火花不断引爆,燃烧产物全是气体.
空气与A的体积比为a,为使A充分燃烧,a的最小值为
若a值偏小,则汽车尾气中增多的污染气体的化学式为
若a值偏大,汽车尾气中增多的污染气体总称为
(2)B为乙烯、乙炔和氢气的混合气体,测得其在标准状况下的密度为0.478g/L,使该混合气体在加热的条件下通过镍催化剂并充分反应,再冷却到标准状况下测其密度为1.062g/L,试求出B中各气体的体积分数.
考点:有机物的推断,有关有机物分子式确定的计算
专题:有机物分子组成通式的应用规律
分析:(1)根据烷烃通式CnH2n+2可得,烷烃的相对分子量为:14n+2=114进行计算;
根据方程式计算出辛烷与氧气恰好反应时,辛烷与空气的体积比;
若a值偏小,氧气不足,会产生CO有毒气体,根据质量守恒判断系数书写化学方程式在进行计算;
若a值偏大,氧气过量,会产生NO、NO2等氮的氧化物;
(2)B为乙烯、乙炔和氢气的混合气体,测得其在标准状况下的密度为0.478g/L,则平均分子质量=0.478×22.4=10.7;使该混合气体在加热的条件下通过镍催化剂并充分反应,再冷却到标准状况下测其密度为1.062g/L,则平均分子质量=1.062×22.4=23.8,比乙炔的相对分子量还小,说明反应后氢气还过量,所以反应后混合气体由C2H6和H2组成,根据反应C2H4+H2→C2H6,C2H2+2H2→C2H6 化学反应方程式进行计算.
根据方程式计算出辛烷与氧气恰好反应时,辛烷与空气的体积比;
若a值偏小,氧气不足,会产生CO有毒气体,根据质量守恒判断系数书写化学方程式在进行计算;
若a值偏大,氧气过量,会产生NO、NO2等氮的氧化物;
(2)B为乙烯、乙炔和氢气的混合气体,测得其在标准状况下的密度为0.478g/L,则平均分子质量=0.478×22.4=10.7;使该混合气体在加热的条件下通过镍催化剂并充分反应,再冷却到标准状况下测其密度为1.062g/L,则平均分子质量=1.062×22.4=23.8,比乙炔的相对分子量还小,说明反应后氢气还过量,所以反应后混合气体由C2H6和H2组成,根据反应C2H4+H2→C2H6,C2H2+2H2→C2H6 化学反应方程式进行计算.
解答:
解:(1)烷烃通式CnH2n+2可得,烷烃的相对分子量为:14n+2=114,解得n=8,所以分子式为:C8H18;
a值的推算依据:A为C8H18,为辛烷,则辛烷完全燃烧2C8H18+25O2
16CO2+18H2O,则
=
,所以,a=
=
=62.5;
若a值偏小,空气与A的体积比<a时,氧气不足,除生成CO2和H2O外,还会产生CO有毒气体,污染大气.设当燃烧1mol辛烷该污染气体含x molCO时,根据质量守恒,
反应方程式为C8H18+
(25-x)O2
xCO+(8-x)CO2+9H2O,根据以上计算当完全燃烧1mol辛烷时,消耗空气为62.5mol,当a值减小10%时,只消耗空气为62.5×90%=56.25mol,则氧气为56.25×
=11.25,即
(25-x)=11.25,解得x=2.5,所以该污染气体的体积分数为
×100%=31.25%;
若a值偏大,氧气过量,在放电条件下,发生反应N2+O2
2NO,2NO+O2═2NO2,会产生NO、NO2有毒气体,污染大气;
故答案为:C8H18;62.5;CO;31.25%;氮的氧化物;
(2)B为乙烯、乙炔和氢气的混合气体,测得其在标准状况下的密度为0.478g/L,则平均分子质量=0.478×22.4=10.7;使该混合气体在加热的条件下通过镍催化剂并充分反应,再冷却到标准状况下测其密度为1.062g/L,则平均分子质量=1.062×22.4=23.8,比乙炔的相对分子量还小,说明反应氢气还过量,所以反应后混合气体由C2H6和H2组成,根据反应C2H4+H2→C2H6,C2H2+2H2→C2H6
设反应后H2的体积分数为x,则C2H6的体积分数为(1-x).依题意:
2x+30×(1-x)=23.8,解得x=0.221.
又设反应前混合气体体积是YL,则同温、同压下反应后的气体体积为:0.478Y÷1.062=0.45YL.
反应后,H2的体积为0.45Y×0.221=0.1YL,C2H6的体积为0.35Y L.
再设反应前混合气体中C2H4、C2H2、H2分别为aL、bL、cL,根据化学反应方程式,有
解得a=0.15Y;b=0.2Y;c=0.65Y;
所以原混合气体中,C2H4、C2H2、H2的体积分数分别为
×100%=15%、
×100%=20%、
×100%=65%;答:C2H4、C2H2、H2的体积分数分别为
×100%=15%、
×100%=20%、
×100%=65%;
a值的推算依据:A为C8H18,为辛烷,则辛烷完全燃烧2C8H18+25O2
| 点燃 |
| V(C 8H 18) | ||
|
| 2 |
| 25 |
| V(空气) |
| V(C 8H 18) |
| 5×25 |
| 2 |
若a值偏小,空气与A的体积比<a时,氧气不足,除生成CO2和H2O外,还会产生CO有毒气体,污染大气.设当燃烧1mol辛烷该污染气体含x molCO时,根据质量守恒,
反应方程式为C8H18+
| 1 |
| 2 |
| 点燃 |
| 1 |
| 5 |
| 1 |
| 2 |
| 2.5 |
| 8 |
若a值偏大,氧气过量,在放电条件下,发生反应N2+O2
| ||
故答案为:C8H18;62.5;CO;31.25%;氮的氧化物;
(2)B为乙烯、乙炔和氢气的混合气体,测得其在标准状况下的密度为0.478g/L,则平均分子质量=0.478×22.4=10.7;使该混合气体在加热的条件下通过镍催化剂并充分反应,再冷却到标准状况下测其密度为1.062g/L,则平均分子质量=1.062×22.4=23.8,比乙炔的相对分子量还小,说明反应氢气还过量,所以反应后混合气体由C2H6和H2组成,根据反应C2H4+H2→C2H6,C2H2+2H2→C2H6
设反应后H2的体积分数为x,则C2H6的体积分数为(1-x).依题意:
2x+30×(1-x)=23.8,解得x=0.221.
又设反应前混合气体体积是YL,则同温、同压下反应后的气体体积为:0.478Y÷1.062=0.45YL.
反应后,H2的体积为0.45Y×0.221=0.1YL,C2H6的体积为0.35Y L.
再设反应前混合气体中C2H4、C2H2、H2分别为aL、bL、cL,根据化学反应方程式,有
|
解得a=0.15Y;b=0.2Y;c=0.65Y;
所以原混合气体中,C2H4、C2H2、H2的体积分数分别为
| 0.15Y |
| Y |
| 0.2Y |
| Y |
| 0.65Y |
| Y |
| 0.15Y |
| Y |
| 0.2Y |
| Y |
| 0.65Y |
| Y |
点评:本题主要考查了有关烃的分子式、燃烧的相关计算以及气体体积分数的计算,难度较大,关键在于找出辛烷与氧气恰好反应时,辛烷与空气的体积比和利用好标准状况下的密度是解答(2)的关键.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
下列离子方程式正确的是( )
A、用惰性电极电解饱和氯化钠溶液:2Cl-+2H+
| ||||
B、氯气通入浓氢氧化钠溶液中加热:3Cl2+6OH-
| ||||
| C、用稀硝酸溶解FeS固体:FeS+2H+═Fe2++H2S↑ | ||||
| D、硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
在一条件下,可逆反应2A(气)+B(气)?n(C)(固)+D(气)
达到平衡.若维持温度不变,增大强压,测得混合气体的平均相对分子质量不发生改变,则下列判断正确的是( )
达到平衡.若维持温度不变,增大强压,测得混合气体的平均相对分子质量不发生改变,则下列判断正确的是( )
| A、其它条件不变,增大压强,平衡不发生移动 | ||||
| B、其它条件不变,增大压强,混合气体的总质量不变 | ||||
C、反应可以从正反应开始,也可以从逆反应开始,但必须满足下列条件:其中x、y、z分别表示第一次达到平衡时,A、B、D的物质的量(mol),(其中M表示物质的摩尔质量,下同)
| ||||
D、反应只能从正反应开始,且原混合气中A与B的物质的量之比为2:1,并有
|
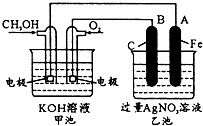 如图是一个化学过程的示意图.已知甲池的总反应式为:
如图是一个化学过程的示意图.已知甲池的总反应式为:
 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
