题目内容
19.海水中有取之不尽的化学资源,从海水中可提取多种化工原料,如图是某化工厂对海水资源综合利用的示意图: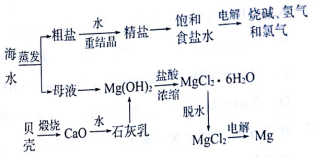
试回答下列问题:
(1)实验室里将粗盐制成精盐的过程中,过滤的操作需用到玻璃棒,玻璃棒的作用是:引流,使待滤液体沿玻璃棒流入漏斗,还需要的玻璃仪器有:烧杯、漏斗.
(2)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中:①加入过量的BaC12溶液,②过量的NaOH溶液,③过量的Na2C03溶液,则添加试剂顺序为②①③或①②③(填写序号),最后在滤液加入盐酸至溶液呈中性.请写出加入盐酸后可能发生反应的离子方程式:H++OH-═H2O、2H++CO32-═H2O+CO2↑.
(3)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子.从离子反应的角度考虑,在母液里加入石灰乳发生反应的离子方程式:Ca(OH)2+Mg2+═Mg(OH)2+Ca2+.
(4)电解无水氯化镁制取镁的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.将镁蒸气冷却后即为固体镁,镁蒸气需在Ar气氛围中冷却,理由:避免Mg被空气中的氧气氧化.
分析 海水蒸发得到粗盐和母液,粗盐加入水溶解,重结晶得到精盐,电解饱和食盐水得到烧碱、氢气和氯气,母液中加入利用贝壳煅烧生成的氧化钙溶于水得到石灰乳,沉淀镁离子生成氢氧化镁沉淀,过滤得到沉淀中加入盐酸溶解,蒸发浓缩,冷却结晶得到氯化镁晶体,在氯化氢中受热分解脱水得到氯化镁固体,通电电解熔融氯化镁生成镁和氯气,
(1)过滤时用到玻璃棒是起到引流的作用,过滤操作需要烧杯、玻璃棒、漏斗;
(2)根据根据SO42-、Ca 2+、Mg2+等易转化为沉淀而被除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的溶液;根据除杂试剂NaOH和Na2CO3过量二者都能与盐酸反应写出反应的离子方程式;
(3)母液中有K+、Na+、Mg2+等阳离子,在母液里加入石灰乳,与镁离子反应;
(4)电解熔融MgCl2反应,镁离子在阴极得到电子发生还原反应生成镁,氯离子在阳极失电子发生氧化反应生成氯气;Ar气氛围中气体与镁不反应.
解答 解:海水蒸发得到粗盐和母液,粗盐加入水溶解,重结晶得到精盐,母液中加入利用贝壳煅烧生成的氧化钙溶于水得到石灰乳,沉淀镁离子生成氢氧化镁沉淀,过滤得到沉淀中加入盐酸溶解,蒸发浓缩,冷却结晶得到氯化镁晶体,在氯化氢中受热分解脱水得到氯化镁固体,通电电解熔融氯化镁生成镁和氯气,
(1)实验室里将粗盐制成精盐的过程中,过滤的操作需用到玻璃棒,玻璃棒的作用是引流,使待滤液体沿玻璃棒流入漏斗,还需要的玻璃仪器有烧杯、漏斗,
故答案为:引流,使待滤液体沿玻璃棒流入漏斗; 烧杯、漏斗;
(2)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,所以正确顺序为②①③或①②③;因NaOH和Na2CO3过量,能与盐酸反应,最后在滤液加入盐酸至溶液呈中性,所以离子方程式为:H++OH-═H2O、2H++CO32-═H2O+CO2↑,
故答案为:②①③或①②③;H++OH-═H2O、2H++CO32-═H2O+CO2↑;
(3)母液中有K+、Na+、Mg2+等阳离子,在母液里加入石灰乳,与镁离子反应,反应的离子方程式为:Ca(OH)2+Mg2+═Mg(OH)2+Ca2+,
故答案为:Ca(OH)2+Mg2+═Mg(OH)2+Ca2+;
(4)电解熔融MgCl2的反应化学方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,将镁蒸气冷却后即为固体镁,镁蒸气需在Ar气氛围中冷却,避免Mg被空气中的氧气氧化,
故答案为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;避免Mg被空气中的氧气氧化.
点评 本题考查较综合,涉及粗盐提纯、物质性质,离子方程式书写等,为高考常见题型,利用所学知识结合流程图信息是解答本题的关键,题目难度中等.

| A. | a=2b时,生成沉淀98.5ag | |
| B. | a≤b≤2a时,溶液中含n(NaOH):n(Na2CO3)=(2a-b):(b-a) | |
| C. | 0<b<2a时,沉淀质量随着NaHCO3的加入而不断增加 | |
| D. | b=$\frac{3}{2}$a时,总离子方程式为:3HCO3-+2Ba2++3OH-=2BaCO3↓+CO32-+3H2O |
| A. | 简单离子半径:X<W<Z | |
| B. | W、X、Y元素形成的盐溶于水,溶液一定呈中性 | |
| C. | W与X形成的常见化合物中阴、阳离子个数比均为1:2 | |
| D. | 1 mol Z 的单质与足量的NaOH溶液反应转移电子数1 NA |
 已知X、Y、Z、W为短周期元素,X的一种核素的质子数为8;Y和Ne原子的原子核外电子数相差1;Z的单质是一种常见的半导体材料;W的非金属性在同周期元素中最强.其原子半径随原子序数的变化如图所示.下列说法不正确的是( )
已知X、Y、Z、W为短周期元素,X的一种核素的质子数为8;Y和Ne原子的原子核外电子数相差1;Z的单质是一种常见的半导体材料;W的非金属性在同周期元素中最强.其原子半径随原子序数的变化如图所示.下列说法不正确的是( )| A. | ZX2为酸性氧化物,只能与碱溶液反应 | |
| B. | 简单氢化物的热稳定性:Z<W | |
| C. | 化合物YWX中既含离子键,又含共价键 | |
| D. | W的最高价氧化物对应的水化物为强酸 |
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4•7H2O | 30.9 | 35.5 | 40.8 | 45.6 | - |
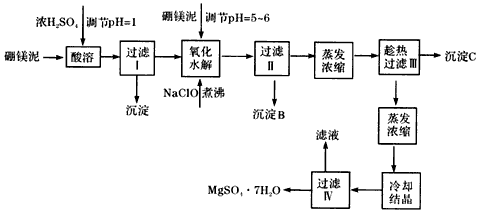
根据以上流程图并参考表格数据,试回答下列问题:
(1)在酸溶过程中,想加快酸溶速度,提出两种可行的措施加热,搅拌或将固体粉碎.
(2)沉淀A中除二氧化硅外,还含有硼酸(H3BO3),硼酸微溶于水,为一元弱酸,其酸性不来源于羟基的电离,写出硼酸水溶液电离方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-
(3)经对沉淀B进行分析,发现其中含有二氧化锰,用离子方程式解释产生二氧化锰原因:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
(4)加入硼镁泥调节pH=5~6目的是使溶液中的Al3+和Fe3+完全转化为沉淀而折出.
(5)得到的沉淀C的组成是CaSO4•2H2O或CaSO4(填化学式),过滤Ⅲ需趁热过滤,原因是趁热过滤有利于分离CaSO4和MgSO4并防止MgSO4在温度低时结晶析出
(6)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是取过滤Ⅱ后的溶液1~2ml丁试管中,加入少量KSCN溶液,如果溶液显红色,证明滤液中有Fe3+,否则无.
( )
| A. | 恒容充入N2 | B. | 缩小体积使压强增大 | ||
| C. | 恒容充入氦气 | D. | 恒压充入氦气 |
| A. | 0.125mol•L-1•min-1 | B. | 0.100 mol•L-1•s-1 | ||
| C. | 0.200 mol•L-1•min-1 | D. | 0.375 mol•L-1•s-1 |
| A. | 由溴丙烷水解制丙醇;由苯甲酸乙酯水解制苯甲酸和乙醇 | |
| B. | 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 | |
| C. | 由氯代环己烷消去制环己烯;由丙烯加溴制1,2二溴丙烷 | |
| D. | 由乙酸和乙醇制乙酸乙酯;由丙烯与水反应制丙醇 |
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 | |
| C. | 浓氨水中滴加饱和FeCl3溶液可制得氢氧化铁胶体 | |
| D. | 胶体不一定是液态,胶体的丁达尔效应属于物理变化 |