题目内容
1.将0.2mol AgNO3、0.4mol Cu(NO3)2和0.6mol KCl溶于水配成100mL溶液,用惰性电极电解一段时间后,在一极上析出0.3mol Cu,此时,另一极上的气体体积(标准状况)为( )| A. | 4.48 L | B. | 5.6 L | C. | 6.7 L | D. | 7.8 L |
分析 Ag+和Cl-反应生成AgCl沉淀,电解时溶液中不存在Ag+,阴离子放电顺序为Cl->OH-,若在一极析出0.3molCu,阴极得到电子为0.3mol×2=0.6mol,结合两极转移电子数目相等以及电极方程式计算.
解答 解:Ag+和Cl-反应生成AgCl沉淀,电解时溶液中不存在Ag+,
反应后溶液中存在0.4molCu2+、0.4molCl-,
若在一极析出0.3molCu,阴极得到电子为0.3mol×2=0.6mol,
阳极首先发生:2Cl--2e-=Cl2↑,然后发生4OH--4e-=O2+2H2O,
则0.4molCl-生成0.2molCl2,失去0.4mol电子,在反应中4OH--4e-=O2+2H2O,转移0.2mol电子,生成0.05molO2,
则气体的体积为(0.2mol+0.05mol)×22.4L/mol=5.6L,
故选B.
点评 本题考查电解原理,为高考常见题型,侧重于学生的分析能力的考查,注意把握离子的放电顺序,为解答该题的关键,难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
12.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1molCl2作为反应物,转移电子数一定为2NA | |
| B. | 25℃时,1.0LpH=13的Ba(OH)2溶液中水电离的OH-数目为0.1NA | |
| C. | 17g烃基和17gOH-含有的电子数均为10NA | |
| D. | 标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体分子数小于NA |
9.向含amolBa(OH)2的溶液中逐滴加入含bmolNaHCO3的溶液,充分反应(不考虑盐类的水解反应及沉淀溶解).下列说法不正确的是( )
| A. | a=2b时,生成沉淀98.5ag | |
| B. | a≤b≤2a时,溶液中含n(NaOH):n(Na2CO3)=(2a-b):(b-a) | |
| C. | 0<b<2a时,沉淀质量随着NaHCO3的加入而不断增加 | |
| D. | b=$\frac{3}{2}$a时,总离子方程式为:3HCO3-+2Ba2++3OH-=2BaCO3↓+CO32-+3H2O |
16.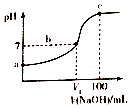 已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )
已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )
 已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )
已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )| A. | a点溶液的pH=4 | |
| B. | b点溶液中存在:c(A-)>c(Na+)>c(H+)=c(OH-) | |
| C. | b点c(HA)/c(A-)=5 | |
| D. | c点c(A-)+c(H+)=c(Na+)+c(OH-) |
6.下列各项中:①土地沙漠化②酸雨③水资源危机④臭氧层空洞⑤沙尘暴,其中属于因人类生产、生活对环境造成破坏的是( )
| A. | 只有①②⑤ | B. | 只有①②③⑤ | C. | 只有②③④ | D. | 全部 |
13.下列有关化学事实或现象解释正确的是( )
| A. | 将浓硝酸加入盛有铂、金的烧杯中,不反应,再加入一定量浓盐酸后,铂、金溶解,不能说明浓硝酸氧化性比浓盐酸强 | |
| B. | 石英玻璃、普通玻璃、陶瓷及水泥均属于硅酸盐产品 | |
| C. | 电解AlCl3水溶液,阴极周围出现白色胶状沉淀,说明Al(OH)3胶体粒子带正电荷 | |
| D. | 气体甲通入溶液乙,溶液乙的颜色褪去,说明气体甲具有漂白性 |
10.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径在短周期主族元素原子中最大,Y的核外电子数是W的2倍且同主族.下列说法不正确的是( )
| A. | 简单离子半径:X<W<Z | |
| B. | W、X、Y元素形成的盐溶于水,溶液一定呈中性 | |
| C. | W与X形成的常见化合物中阴、阳离子个数比均为1:2 | |
| D. | 1 mol Z 的单质与足量的NaOH溶液反应转移电子数1 NA |
11.在一定的温度下,向一个容积为2L的恒容密闭容器中(事先装入催化剂),充入2molN2和3molH2,3min后测得密闭容器内的压强是起始时的0.9倍.在这段时间内,用H2表示该反应的平均反应速率是( )
| A. | 0.125mol•L-1•min-1 | B. | 0.100 mol•L-1•s-1 | ||
| C. | 0.200 mol•L-1•min-1 | D. | 0.375 mol•L-1•s-1 |