题目内容
13.设NA表示阿伏加德罗常数的值,下列判断正确的是( )| A. | 常温下,pH=1的盐酸溶液中,由水电离的H+个数为10-13NA | |
| B. | 标准状况下,氧原子总数为0.2NA的CO2和NO2的混合气体,其体积为2.24L | |
| C. | 常温下,5.6g铁分别与足量氯气和稀硝酸反应,转移的电子数目均为0.3NA | |
| D. | 100g46%乙醇溶液中所含O-H数目为7NA |
分析 A.溶液体积未知;
B.CO2和NO2的都含有2个氧原子;
C.铁与氯气、足量稀硝酸反应都生成三价铁离子;
D.乙醇溶液中,乙醇、水分子都含有O-H键.
解答 解:A.溶液体积未知,无法计算由水电离的H+个数,故A错误;
B.CO2和NO2的都含有2个氧原子,二氧化氮与四氧化二氮存在转化:2NO2?N2O4,所以氧原子总数为0.2NA的CO2和NO2的混合气体物质的量小于0.1mol,标况下体积小于2.24L,故B错误;
C.铁与氯气、足量稀硝酸反应都生成三价铁离子,5.6g铁物质的量为:0.1mol,转移电子数为0.3NA,故C正确;
D.乙醇溶液中,乙醇、水分子都含有O-H键,所以100g46%乙醇溶液中所含O-H数目大于7NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算及应用,掌握物质的量的计算公式和物质结构是解题关键,注意有机物结构特点,难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
3.下列依据相关实验得出的结论正确的是( )
| A. | 向浓度均为0.1 mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明Ksp(AgCl)<Ksp(AgI) | |
| B. | 在含FeCl3杂质的FeCl2溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl2溶液 | |
| C. | 用激光笔分别照射蛋清溶液和葡萄糖溶液,能产生光亮“通路”的是蛋清溶液 | |
| D. | 用铂丝蘸取某溶液进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色,该溶液一定是钾盐溶液 |
1.下列反应既是氧化还原反应,又是放热反应的是( )
| A. | 铝片与稀硫酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 红热的焦炭与水蒸气的反应 |
18.下列过程中能量升高的是:( )
| A. | 4H+C→CH4 | B. | CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+5H2O | ||
| C. | CaO+H2O=Ca(OH)2 | D. | CO2(g)→CO2(s) |
2.NA为阿伏加德罗常数的值.下列说法中,正确的是( )
| A. | 常温常压下,5.6g Fe与足量Cl2充分反应转移电子总数为0.2NA | |
| B. | 密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 1 L 0.lmol•L-1的CH3COONa溶液中CH3COO-和CH3COOH粒子数之和为0.1NA |
3.下列实验中,所采取的分离方法不正确的是( )
| 选项 | 目的 | 分离方法 |
| A | 除去铜器表面的铜绿【Cu2(OH)2CO3】 | 用盐酸浸泡,用清水冲洗 |
| B | 除去乙醇中的少量水 | 加生石灰,再蒸馏 |
| C | 除去 HCl中的 C12 | 通过饱和食盐水洗气再干燥 |
| D | 除去NaCl固 体中的 NH4Cl | 加热 |
| A. | A | B. | B | C. | C | D. | D |
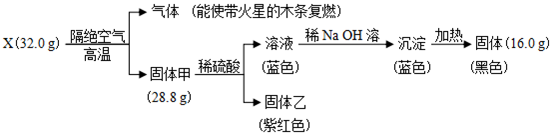
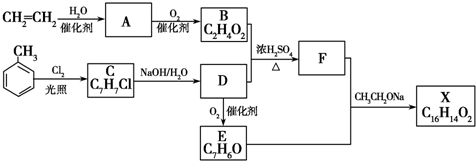
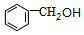 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O.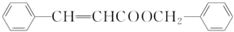 .
.