题目内容
18.下列过程中能量升高的是:( )| A. | 4H+C→CH4 | B. | CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+5H2O | ||
| C. | CaO+H2O=Ca(OH)2 | D. | CO2(g)→CO2(s) |
分析 能量升高,为吸热过程,常见反应大多数分解反应、C、氢气、CO为还原剂的氧化还原反应以及共价键的断裂等,以此解答该题.
解答 解:A.为共价键的形成过程,为放热过程,能量降低,故A错误;
B.为分解反应,需吸收能量,能量升高,故B正确;
C.反应放热,能量降低,故C错误;
D.物质由气态变为固体放热,降低能量,故D错误.
故选B.
点评 本题考查反应热与焓变,为高频考点,侧重考查学生的分析能力,注意把握常见物质的变化与能量的关系,难度不大.

练习册系列答案
相关题目
8.某溶液中所含离子的浓度如下表,则Mn+及a值可能分别为( )
| 离子 | NO3- | SO42- | H+ | Al3+ | Mn+ |
| 浓度(mol•L-1) | 3 | 4 | 2 | 2 | a |
| A. | Ag+、1.5 | B. | Mg2+、1.5 | C. | Ba2+、1.5 | D. | Fe3+、0.5 |
9.下列各组有机物,无论它们以何种物质的量的比例混合,只要总物质的量一定,则在完全燃烧时,消耗O2的量为一恒定值的是( )
| A. | C5H10和C6H8 | B. | C2H6和C3H8 | C. | C3H6和C3H8O | D. | C2H6O和C2H4O2 |
13.设NA表示阿伏加德罗常数的值,下列判断正确的是( )
| A. | 常温下,pH=1的盐酸溶液中,由水电离的H+个数为10-13NA | |
| B. | 标准状况下,氧原子总数为0.2NA的CO2和NO2的混合气体,其体积为2.24L | |
| C. | 常温下,5.6g铁分别与足量氯气和稀硝酸反应,转移的电子数目均为0.3NA | |
| D. | 100g46%乙醇溶液中所含O-H数目为7NA |
3.有关能量的判断或表示方法正确的是( )
| A. | 已知中和热为57.3kJ/mol,则含0.5mol H2SO4的浓溶液与含1molNaOH的溶液混合,放出热量为57.3 kJ | |
| B. | 从C(石墨)=C(金刚石)△H=+119kJ/mol;可知:石墨比金刚石更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多 | |
| D. | 2g H2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2 H2O(l)△H=-285.8kJ/mol |
7.由分类思想,下列说法正确的是( )
| A. | 氢氧化钠溶液、盐酸都为强电解质 | |
| B. | 铁生锈、食物腐败都涉及有氧化还原反应 | |
| C. | 漂白粉、冰醋酸、氢氧化铁胶体均为混合物 | |
| D. | 二氧化氮、二氧化硅都是酸性氧化物 |
8.获得“863”计划和中科院一百人计划支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,已知电池总反应为2Al+3I2═2AlI3.下列说法不正确的是( )
| A. | 该电池负极的电极反应为:Al-3e═Al3+ | |
| B. | 电池工作时,溶液中的铝离子向正极移动 | |
| C. | 消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多 | |
| D. | 正极的电极材料是单质碘 |
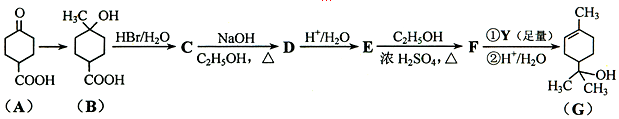
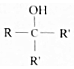
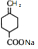 .
.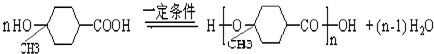 ;写出同时满足下列条件的B的链状同分异构体的结构简式
;写出同时满足下列条件的B的链状同分异构体的结构简式 .
. 名称:2,3-二甲基辛烷
名称:2,3-二甲基辛烷 名称:3,5-二甲基庚烷.
名称:3,5-二甲基庚烷.