题目内容
8.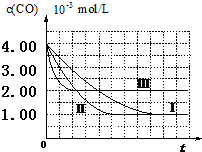 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 6.50×10-3 | 120 | |||
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.50×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol•L-1.用N2表示其反应速率为0.15mol•L-1•s-1,则所经过的时间为B;
A.2s B.3s C.4s D.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是D;
A.v(H2)=0.1mol•L-1•min-1 B.v(N2)=0.1mol•L-1•min-1
C.v(NH3)=0.15mol•L-1•min-1 D.v(N2)=0.002mol•L-1•s-1.
分析 (I)(1)实验目的是:探究某些外界条件对汽车尾气转化反应速率的影响规律,应采取控制变量法进行研究,实验I、Ⅱ催化剂比表面积不同,其它条件相同;
(2)由方程式可知△c(CO)=△c(NO),平衡时NO浓度=NO起始浓度-NO浓度变化量;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,缩短到达平衡的时间,汽车尾气转化速率增大;
(II)(1)利用速率之比等于化学计量数之比,根据N2表示的平均反应速率v(N2)计算速率v(NH3),再根据速率定义计算反应时间;
(2)同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比,先把不同物质的反应速率换算成同一物质的反应速率进行比较,注意单位保持一致.
解答 解:(I)(1)实验目的是:探究某些外界条件对汽车尾气转化反应速率的影响规律,应采取控制变量法进行研究,实验I、Ⅱ催化剂比表面积不同,其它条件要相同,是探究催化剂比表面积对尾气转化速率的影响,故Ⅱ中的温度为280℃,CO的初始浓度为4.00×10-3mol/L,
故答案为:
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | |||||
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响 | 280 | 4.00×10-3 | ||
| Ⅲ |
故答案为:3.5×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,缩短到达平衡的时间,汽车尾气转化速率增大,
故答案为:增大;
(II)(1)由于v(N2)=0.15mol/(L•s),速率之比等于化学计量数之比,所以v(NH3)=2v(N2)=2×0.15mol/(L•s)=0.3mol/(L•s),所以反应所经历的时间为 $\frac{0.9mol•{L}^{-1}}{0.3mol•{L}^{-1}•{s}^{-1}}$=3s,
故答案为:B;
(2)反应为N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$ 2NH3(g),以氢气的反应速率为标准进行判断:
A.v(H2)=0.1mol•L-1•min-1;
B.v(N2)=0.1mol•L-1•min-1,反应速率之比等于其计量数之比,所以v(H2)=3v(N2)=0.3mol•L-1•min-1;
C.v(NH3)=0.15mol•L-1•min-1,反应速率之比等于其计量数之比,所以v(H2)=$\frac{3}{2}$v(NH3)=0.225mol/(L•min);
D.v(N2)=0.002mol•L-1•s-1=0.12mol•L-1•min-1,反应速率之比等于其计量数之比,所以v(H2)=3v(N2)=0.36mol/(L•min),所以反应速率最快的是D,
故选D.
点评 本题考查化学平衡计算、外界条件对反应速率的影响、化学反应速率计算、反应速率快慢比较等,I中注意利用控制变量法分析解答,反应速率快慢比较还可用速率与其化学计量数的比值大小判断,比值越大,表示反应速率越快,难度中等.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
19.阿司匹林(乙酰水杨酸,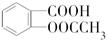 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
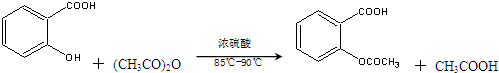
制备基本操作流程如下:
醋酸酐+水杨酸$\stackrel{浓硫酸}{→}$$\stackrel{摇匀}{→}$$\stackrel{85-90℃℃加热}{→}$$\stackrel{冷却}{→}$$→_{洗涤}^{减压过滤}$粗产品
主要试剂和产品的物理常数如下表所示:
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是乙酸酐与水反应.
(2)合成阿司匹林时,最合适的加热方法是水浴加热.
(3)提纯粗产品流程如下,加热回流装置如图:
粗产品$→_{沸石}^{乙酸乙酯}$$→_{回流}^{加热}$$\stackrel{趁热过滤}{→}$$→_{减压过滤}^{冷却}$$→_{干燥}^{洗涤}$乙酰水杨酸
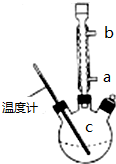
①使用温度计的目的是控制加热的温度,防止乙酰水杨酸受热易分解.
②冷凝水的流进方向是a(填“a”或“b”);
③趁热过滤的原因是防止乙酰水杨酸结晶析出.
④下列说法正确的是abc(填选项字母).
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时小
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%(用百分数表示,小数点后一位).
 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
制备基本操作流程如下:
醋酸酐+水杨酸$\stackrel{浓硫酸}{→}$$\stackrel{摇匀}{→}$$\stackrel{85-90℃℃加热}{→}$$\stackrel{冷却}{→}$$→_{洗涤}^{减压过滤}$粗产品
主要试剂和产品的物理常数如下表所示:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是乙酸酐与水反应.
(2)合成阿司匹林时,最合适的加热方法是水浴加热.
(3)提纯粗产品流程如下,加热回流装置如图:
粗产品$→_{沸石}^{乙酸乙酯}$$→_{回流}^{加热}$$\stackrel{趁热过滤}{→}$$→_{减压过滤}^{冷却}$$→_{干燥}^{洗涤}$乙酰水杨酸

①使用温度计的目的是控制加热的温度,防止乙酰水杨酸受热易分解.
②冷凝水的流进方向是a(填“a”或“b”);
③趁热过滤的原因是防止乙酰水杨酸结晶析出.
④下列说法正确的是abc(填选项字母).
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时小
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%(用百分数表示,小数点后一位).
16.下列说法中正确的是( )
| A. | 难溶电解质的Ksp越小,溶解度就一定越小 | |
| B. | 向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 | |
| C. | 用饱和Na2CO3溶液可以将BaSO4转化为BaCO3,说明Ksp(BaCO3)小于Ksp(BaSO4) | |
| D. | 一般认为沉淀离子浓度小于1.0×10-5 mol/L时,离子就已沉淀完全 |
3.在5ml 0.1mol/L KI溶液中滴加0.1mol/LFeCl3溶液5-6滴后,再进行下列实验,其中可证明FeC13溶液和KI溶液的反应是可逆反应的实验是( )
| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CC14振荡后,观察下层液体颜色 | |
| C. | 加入CC14振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生 | |
| D. | 加入CC14振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色 |
13.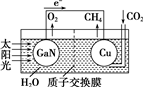 科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4.下列有关说法中正确的是( )
科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4.下列有关说法中正确的是( )
 科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4.下列有关说法中正确的是( )
科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4.下列有关说法中正确的是( )| A. | 该装置是将化学能转化为电能 | |
| B. | 氮化镓电极是阳极 | |
| C. | 铜电极表面的电极反应式为CO2+8e-+8H+═CH4+2H2O | |
| D. | 可用盐酸作该装置的电解液 |
20.下列说法正确的是( )
| A. | 分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液 | |
| B. | 焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化 | |
| C. | 生石灰用作食品抗氧剂 | |
| D. | “海水淡化”可以解决“淡水供应危机”,但加入明矾不能使海水淡化 |
17.青蒿素结构式如图所示.下列有关青蒿素的说法错误的是( )
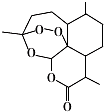

| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素分子结构稳定,受热不易分解 | |
| C. | 青蒿素中含多个环状结构,其中有一个六元碳环 | |
| D. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏 |