题目内容
7.“碘钟”实验中,3I-+S2O${\;}_{8}^{2-}$═I${\;}_{3}^{-}$+2SO${\;}_{4}^{2-}$的反应速率可以用I${\;}_{3}^{-}$与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,得到的数据如下表:| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O${\;}_{8}^{2-}$)/mol/L | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
(1)该实验的目的是:研究反应物I-与S2O82-的浓度对反应速率的影响.
(2)根据①、②、⑤三个实验的数据,推测显色时间t1=29.3s.
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为A(填字母).
A.<22.0s B.22.0~44.0s C.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比.
分析 (1)根据图表已知物理量判断;
(2)根据浓度与时间的关系对比后得出规律再计算;
(3)根据温度与反应速率的关系判断;
(4)根据图表中物理量对比得出结论.
解答 解:(1)图表中的物理量是反应物浓度与时间,通过分析知,反应物的浓度与时间成反比,浓度的变化量与时间的比值为速率,所以得出反应物浓度与反应速率的关系.
故答案为:研究反应物I-与S2O82-的浓度对反应速率的影响.
(2)对比数据组①和②,可以看到,c (S2O82-)不变,c (I-)增大到2倍时,反应时间缩短了一半,即反应速率加快了一倍;
对比实验①和⑤,实验⑤的c (I-)为实验①的3倍,而c (S2O82-)保持不变,则由此可计算实验⑤的反应时间应为实验①反应时间的$\frac{1}{3}$,即t1=88s×$\frac{1}{3}$=29.3s
(3)温度越高,化学反应速率越快,所用时间越短,故选A.
(4)对比数据组①和②,可以看到,c (S2O82-)不变,c (I-)增大到2倍时,反应时间缩短了一半,即反应速率加快了一倍;
对比数据组②和③,可以看到,c (I-)不变,c (S2O82-)增大到2倍时,反应时间缩短了一半,即反应速率也加快了一倍;
对比数据组③和④,可以看到,c (S2O82-)增大到2倍时,c (I-)变为1/4倍时,反应时间增大了一倍,即反应速率减慢了一倍;
对比数据组对比数据组①和③,可以看到,c (I-)和c (S2O82-)均增大到2倍时,反应时间为原反应时间的1/4,即反应速率加快了4倍.
可见两个反应物的浓度和反应速率之间的数学关系是:反应物浓度每增加一倍,反应时间就减少一倍,对于两个反应物来说都是如此,可得出结论:反应速率与反应物起始浓度乘积成正比.
故答案为:反应速率与反应物起始浓度乘积成正比或显色时间与反应物起始浓度乘积成反比.
点评 该题图表的分析方法:先比较两组数据的不同点,再分析不同点说明的问题,从而确定它们之间关系.
如:①、②两组数据的不同点是c(I-)和时间,浓度越大,时间越短,浓度的变化量与时间的比值为速率,所以浓度越大,反应速率越快.

 阅读快车系列答案
阅读快车系列答案| A. | CH3COOH在水中电离:CH3COOH═H++CH3COO- | |
| B. | 乙醇氧化成乙醛的化学方程式:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | 乙酸与乙醇发生酯化反应:CH3COOH+CH3CH2OH$→_{△}^{催化剂}$CH3COOCH2CH3 | |
| D. | CaCO3高温分解的热化学方程式:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,△H=+178.5 kJ•mol-1 |
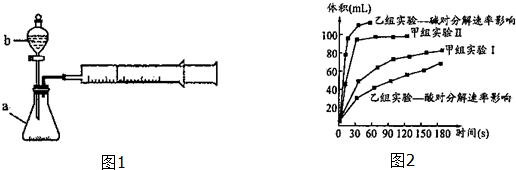
(1)仪器b的名称:分液漏斗.
(2)甲小组有如下实验设计方案,请帮助完成下列填空.
| 实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 做实验参照 | 25 | 3滴FeCl3溶液 | 10ml 2%H2O2 |
| 甲组实验Ⅱ | 探究浓度对速率的影响 | 25 | 10ml 5%H2O2 |
①由甲组实验得出的数据可知:浓度越大,H2O2分解速率越快(填“越快”、“越慢”);
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是K2O2;
③乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2,其化学反应方程式为Ba02+H2SO4=H202+BaSO4↓;支持这一方案的理由是制备H202的环境为酸性环境,H202分解速率较慢.
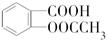 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下: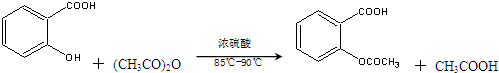
制备基本操作流程如下:
醋酸酐+水杨酸$\stackrel{浓硫酸}{→}$$\stackrel{摇匀}{→}$$\stackrel{85-90℃℃加热}{→}$$\stackrel{冷却}{→}$$→_{洗涤}^{减压过滤}$粗产品
主要试剂和产品的物理常数如下表所示:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是乙酸酐与水反应.
(2)合成阿司匹林时,最合适的加热方法是水浴加热.
(3)提纯粗产品流程如下,加热回流装置如图:
粗产品$→_{沸石}^{乙酸乙酯}$$→_{回流}^{加热}$$\stackrel{趁热过滤}{→}$$→_{减压过滤}^{冷却}$$→_{干燥}^{洗涤}$乙酰水杨酸
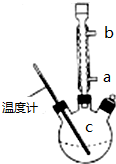
①使用温度计的目的是控制加热的温度,防止乙酰水杨酸受热易分解.
②冷凝水的流进方向是a(填“a”或“b”);
③趁热过滤的原因是防止乙酰水杨酸结晶析出.
④下列说法正确的是abc(填选项字母).
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时小
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%(用百分数表示,小数点后一位).
| A. | 难溶电解质的Ksp越小,溶解度就一定越小 | |
| B. | 向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 | |
| C. | 用饱和Na2CO3溶液可以将BaSO4转化为BaCO3,说明Ksp(BaCO3)小于Ksp(BaSO4) | |
| D. | 一般认为沉淀离子浓度小于1.0×10-5 mol/L时,离子就已沉淀完全 |
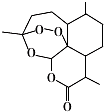
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素分子结构稳定,受热不易分解 | |
| C. | 青蒿素中含多个环状结构,其中有一个六元碳环 | |
| D. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏 |