题目内容
7.稀土是我国战略性资源.氟碳铈矿主要化学成分为CeFCO3,它是提取铈族稀土元素的重要矿物原料.关于氟碳铈矿的冶炼处理工艺已经发展到十数种,其中一种提取铈的工艺流程如下: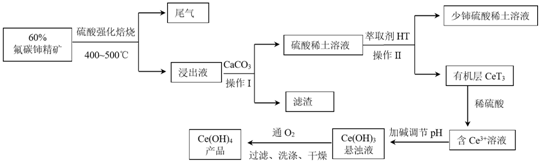
请回答下列问题
(1)为增大反应速率,提高原料的利用率,焙烧前可将矿石粉碎成细颗粒处理.
(2)焙烧过程中产生的SO3尾气常采用喷淋法净化,再用石灰乳中和;操作I中滤渣的主要成分是CaF2、CaSO4.
(3)操作Ⅱ若在实验室中进行,需要的主要玻璃仪器有分液漏斗、烧杯、玻璃棒等;所用萃取剂HT需具备的条件是①②③.
①HT不溶于水,也不和水反应
②Ce3+不和萃取剂HT发生反应
③Ce3+在萃取剂HT中溶解度大于水
④萃取剂HT的密度一定大于水
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+ (水层)+6HT(有机层)═2CeT3(有机层)+6H+(水层)从平衡角度解释:向CeT3 (有机层)加入稀硫酸获得较纯的含Ce3+的水溶液的原因是混合液中加入H2SO4使c(H+)增大,平衡向形成Ge3+水溶液方向移动.
(5)常温下,含Ce3+溶液加碱调至pH=8时,c(Ce3+)=b mol•L-1,已知Ce(OH)3的溶度积=a,则a和b的关系是a=10-18b.
(6)写出Ce(OH)3悬浊液通入氧气得到产品的化学方程式:4Ce(OH)3+O2+2H2O=4Ce(OH)4.
(7)取上述流程中得到的Ce(OH)4产品0.545g,加硫酸溶解后,用0.100 0mol•L-1 FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mL标准溶液.该产品中Ce(OH)4的质量分数为95%[Ce(OH)4的相对分子质量为208,结果保留两位有效数字].
分析 氟碳铈矿主要化学成分为CeFCO3,用硫酸强化焙烧得浸出液中含有,氟离子、铈离子、硫酸等,尾气中主要含有二氧化碳,加入碳酸钙会生成硫酸钙和氟化钙等难溶物为滤渣,和硫酸稀土溶液,在硫酸稀土溶液中加入萃取剂HT,经过分液将溶液中的Ce3+萃取出来,再加入稀硫酸得含有Ce3+的溶液,调节溶液的pH值得Ce(OH)3沉淀,再经过氧气氧化,过滤、洗涤、干燥可得Ce(OH)4产品,
(1)根据影响反应速率的因素可知,为增大反应速率,提高原料的利用率,焙烧前可将矿石粉碎成细颗粒处理;
(2)氟碳铈矿用硫酸强化焙烧得滤液中含有氟离子、铈离子、硫酸等,加入碳酸钙会生成硫酸钙和氟化钙等难溶物,据此答题;
(3)操作II为分液,分液需要的主要玻璃仪器有分液漏斗、烧杯、玻璃棒等;萃取的目的是将溶液中的Ce3+萃取出来,根据萃取剂的要求选择;
(4)根据平衡2Ce3+ (水层)+6HT(有机层)?2CeT3(有机层)+6H+(水层)可知,加入酸平衡向逆反应方程移动,据此分析;
(5)根据溶度积=c3(OH-)•c(Ce3+),结合pH=8及c(Ce3+)=b mol•L-1,可计算出a和b的关系;
(6)根据流程结合元素守恒可知Ce(OH)3结合氧气和水生成Ce(OH)4,据此书写化学方程式;
(7)根据电子得失守恒有关系式Ce(OH)4~FeSO4,根据FeSO4标准溶液中FeSO4的物质的量可计算出Ce(OH)4的质量,进而确定Ce(OH)4的质量分数;
解答 解:(1)根据影响反应速率的因素可知,为增大反应速率,提高原料的利用率,焙烧前可将矿石粉碎成细颗粒处理,
故答案为:粉碎成细颗粒;
(2)氟碳铈矿用硫酸强化焙烧得滤液中含有氟离子、铈离子、硫酸等,加入碳酸钙会生成硫酸钙和氟化钙等难溶物,所以操作I中滤渣的主要成分是CaF2、CaSO4,
故答案为:CaF2、CaSO4;
(3)操作II为分液,分液需要的主要玻璃仪器有分液漏斗、烧杯、玻璃棒等;萃取的目的是将溶液中的Ce3+萃取出来,根据萃取剂的要求选择可知,HT要不溶于水,也不和水反应、Ce3+不和萃取剂HT发生反应、Ce3+在萃取剂HT中溶解度大于水,故选①②③,
故答案为:分液漏斗;①②③;
(4)根据平衡2Ce3+ (水层)+6HT(有机层)?2CeT3(有机层)+6H+(水层)可知,混合液中加入H2SO4使c(H+)增大,平衡向形成Ge3+水溶液方向移动,
故答案为:混合液中加入H2SO4使c(H+)增大,平衡向形成Ge3+水溶液方向移动;
(5)根据题意,溶液中c(OH-)=10-6 mol•L-1,根据溶度积=c3(OH-)•c(Ce3+)可知a=(10-6)3•b,所以a=10-18b,
故答案为:a=10-18b;
(6)根据流程结合元素守恒可知Ce(OH)3结合氧气和水生成Ce(OH)4,反应的化学方程式为4Ce(OH)3+O2+2H2O=4Ce(OH)4,
故答案为:4Ce(OH)3+O2+2H2O=4Ce(OH)4;
(7)根据电子得失守恒有关系式Ce(OH)4~FeSO4,FeSO4标准溶液中FeSO4的物质的量为0.025×0.1mol=0.0025mol,所以Ce(OH)4的质量为0.0025mol×208g/mol=0.52g,则样品中Ce(OH)4的质量分数为$\frac{0.52}{0.545}$×100%=95%,
故答案为:95%.
点评 本题主要考查了影响化学反应速率的因素、物质的分离子操作、化学平衡的移动、氧化还原反应的书写及质量分数的计算,是对化学基础知识的综合考查,对学生综合应用基础知识的能力要求较高,答题时注意守恒的方法及平衡的思想的运用,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 苯、乙醇和乙酸都能发生取代反应 | |
| B. | 等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和NaHCO3溶液鉴别 | |
| D. | 乙烷和丙烯的物质的量各1mol,完成燃烧生成3molH2O |
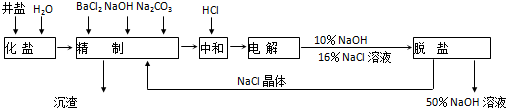
依据如图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极的电极反应式为2Cl--2e-=Cl2↑;
(2)电解过程的总反应的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)电解槽阳极产物可用于制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种)(至少写出两种用途).
(4)工业食盐含Ca2+、Mg2+等杂质,精制过程中除去这2种离子所发生反应的离子方程式为:Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓.
(5)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是a、c
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(6)为了有效除去Ca2+、Mg2+、SO42-加入试剂的合理顺序为b、c
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(7)已知NaOH、NaCl在水中的溶解度数据如下表:
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| NaOH/g | 109 | 118 | 129 | 146 | 177 | 300 | 313 | 318 | 337 |
| NaCl/g | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
| A. | 标准状况下,22.4 L HF中含HF分子数目为NA | |
| B. | 60 g石英晶体中含有的Si-O键数目为2 NA | |
| C. | 标准状况下,11.2 L Cl2通人足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA | |
| D. | l L 0.1 mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA |
| A. | 乙苯和环己烯都能使酸性高锰酸钾溶液褪色 | |
| B. | 糖、油脂、蛋白质都能发生水解反应 | |
| C. | 甲醛和乙二醇都可作为合成高分子化合物的单体 | |
| D. | 丙烷和2-甲基丙烷的一氯代物均为两种 |
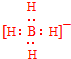 ;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.
;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.
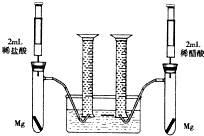 某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图(夹持仪器略):
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图(夹持仪器略):