题目内容
8.(1)鉴别NaCl和Na2CO3溶液的试剂是盐酸,离子方程式为CO32-+2H+=CO2↑+H2O;(2)除去Na2CO3粉末中混入的NaHCO3杂质用加热方法,化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(3)除去Fe2O3中SiO2的试剂是NaOH溶液,离子方程式为2OH-+SiO2=SiO32-+H2O;
(4)明矾在水中的电离方程式是KAl(SO4)2=K++Al3++2SO42-明矾可用作净水的原因是明矾可溶于水,铝离子水解生成Al(OH)3(胶体),Al(OH)3可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清.
分析 (1)碳酸钠与盐酸反应生成气体,而氯化钠不能;
(2)碳酸氢钠加热分解生成碳酸钠;
(3)二氧化硅与NaOH溶液反应,而氧化铁不能;
(4)铝离子水解生成胶体,吸附水中的悬浮杂质而净化水.
解答 解:(1)碳酸钠与盐酸反应生成气体,而氯化钠不能,则鉴别试剂为盐酸,发生的离子反应为CO32-+2H+=CO2↑+H2O,
故答案为:盐酸;CO32-+2H+=CO2↑+H2O;(或硫酸、硝酸等其他合理答案)
(2)碳酸氢钠加热分解生成碳酸钠,则除杂方法为加热,发生的反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:加热;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(3)二氧化硅与NaOH溶液反应,而氧化铁不能,则除杂试剂为NaOH溶液,发生的离子反应为2OH-+SiO2=SiO32-+H2O,
故答案为:NaOH溶液;2OH-+SiO2=SiO32-+H2O;
(4)明矾在水中的电离方程式是KAl(SO4)2=K++Al3++2SO42-,明矾可用作净水的原因是明矾可溶于水,铝离子水解生成Al(OH)3(胶体),Al(OH)3可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清,
故答案为:KAl(SO4)2=K++Al3++2SO42-;明矾可溶于水,铝离子水解生成Al(OH)3(胶体),Al(OH)3可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清.
点评 本题考查物质的鉴别和检验及混合物分离提纯等,为高频考点,把握物质的性质、性质差异及发生的反应和现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

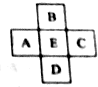 原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )
原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )| A. | 4x | B. | 4x+6 | C. | 4x+10 | D. | 4x+14 |
| A. | AgCl的溶解度增大 | B. | AgCl的溶解度增大,Ksp不变 | ||
| C. | C(Ag+)增大 | D. | AgCl的溶解度、Ksp均不变 |
| A. | Na2SO3溶液(HCl酸化的BaCl2溶液) | B. | 氯水(AgNO3溶液) | ||
| C. | 漂白粉(稀硝酸) | D. | NaOH溶液(Ba(OH)2溶液) |
 取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )
取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )| A. | a电极反应式是4OH--4e-═O2↑+2H2O | B. | b电极是阴极 | ||
| C. | 电解过程中水是氧化剂 | D. | b电极附近溶液的pH变大 |
 A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大,A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,C与B同主族,D元素的价电子数是其余电子数的一半,E与D同族,F与A同主族,回答下列问题:
A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大,A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,C与B同主族,D元素的价电子数是其余电子数的一半,E与D同族,F与A同主族,回答下列问题: ,它的化学键属于共价键;含有离子键和共价键的化合物的化学式为Na2O2.
,它的化学键属于共价键;含有离子键和共价键的化合物的化学式为Na2O2.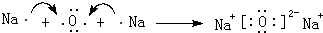 .
.