题目内容
10.A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去).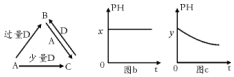
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为3Fe2++4H++NO3-═3Fe3++NO↑+2H2O .
(2)若A为强碱,D为气态氧化物.常温时,将B的水溶液露置于空气中,其pH随时间 t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发).
①若图b符合事实,则D的化学式为CO2;
②若图c符合事实,则其pH变化的原因是2HSO3-+O2=2H++2SO42-(用离子方程式表示)
分析 (1)若A为金属单质,D为某强酸的稀溶液,A和D反应的产物与D的量有关,且B和A反应生成C、C和D反应生成B,说明A为变价金属,为Fe,D为HNO3,则B为Fe(NO3)3、C为Fe(NO3)2;
(2)A为强碱,D为气态氧化物,由转化图可知,A可为NaOH,D为CO2或SO2,B为NaHCO3或NaHSO3,常温时将B的水溶液露置于空气中,若为b,则碳酸氢钠符合,若为c则亚硫酸氢钠符合.
解答 解:(1)若A为金属单质,D为某强酸的稀溶液,A和D反应的产物与D的量有关,且B和A反应生成C、C和D反应生成B,说明A为变价金属,为Fe,D为HNO3,则B为Fe(NO3)3、C为Fe(NO3)2,反应C+D→B的离子方程式为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,
故答案为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
(2)A为强碱,D为气态氧化物,由转化图可知,A可为NaOH,D为CO2或SO2,B为NaHCO3或NaHSO3,常温时将B的水溶液露置于空气中,若为b,则碳酸氢钠符合,若为c则亚硫酸氢钠符合,
①若图b符合事实,则D的化学式为CO2,
故答案为:CO2;
②若图c符合事实,亚硫酸氢钠易被氧化生成硫酸氢钠,酸性增强,离子反应为:2HSO3-+O2═2H++2SO42-,
故答案为:2HSO3-+O2=2H++2SO42-.
点评 本题考查无机物的推断,为高频考点,综合考查元素化合物性质及化学反应原理,侧重分析能力及推断能力的考查,涉及Fe及其化合物转化和非金属及化合物的转化,把握与量有关的反应即可解答,题目难度中等.

练习册系列答案
相关题目
20.配制一定物质的量浓度的Na2CO3溶液时,下下列因素会导致溶液浓度偏高的是( )
| A. | 溶解时有少量液体溅出 | B. | 洗涤液未全部转移到容量瓶中 | ||
| C. | 容量瓶使用前未干燥 | D. | 定容时液面未到刻度线 |
1.如果用铁片和铜片构成柠檬电池,会发生的是( )

| A. | 铜片上发生反应:Cu-2e-═Cu2+ | B. | 铁片是负极,其质量逐渐减小 | ||
| C. | 电流由铁片经导线流向铜片 | D. | 柠檬中蕴含的电能转化为化学能 |
18.已知8838Sr位于IIA族,下列有关Sr的说法不正确的是( )
| A. | 原子半径:Sr>Ca | B. | 最高化合价为+2 | ||
| C. | 8838Sr的中子数为38 | D. | 氢氧化物为强碱 |
15.下列对分子及其性质的解释中,不正确的是( )
| A. | 液态氟化氢分子间存在氢键,所以氟化氢的沸点比氯化氢高 | |
| B. | CH4、CO2、C2H2都是含有极性键的非极性分子 | |
| C. | [Cu(NH3)4]2+中含有离子键、极性键、配位键 | |
| D. | 因为非羟基氧原子数目逐渐减少,所以酸性HClO4>H2SO4>H3PO4 |
2.下列物质中,有非极性键的是( )
| A. | 氮气 | B. | 氯化镁 | C. | 水 | D. | 甲烷 |
19.下列离子方程式错误的是( )
| A. | 硅酸钠溶液中通入CO2气体:SiO32-+H2O+CO2═H2SiO3↓+CO32- | |
| B. | 氯气与氢氧化钾溶液反应:Cl2+OH-═Cl-+ClO-+2H2O | |
| C. | 硫酸铝与氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 小苏打溶液与稀盐酸反应:HCO3-+H+═H2O+CO2↑ |
15.下列离子方程式正确的是( )
| A. | Cl2与NaOH溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | F2与NaOH溶液反应:F2+4OH-═2F-+O2+2H2O | |
| C. | AgNO3溶液中加入少量氨水:Ag++2NH3•H2O═Ag(NH3)2++2H2O | |
| D. | Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
