题目内容
现有25℃时0.1mol/L的氨水,请回答以下问题:
(1)①若向该氨水中加入少量氯化铵固体,NH3?H2O的电离平衡 (“向左”、“向右”或“不”)移动,此时溶液中
(填“增大”、“减小”或“不变”),在该过程中,水的离子积常数Kw (填“增大”、“减小”或“不变”);
②若向该氨水中加入稀盐酸,使其恰好完全中和,所得溶液的pH 7 (填“>”、“<”或“=”),用离子方程式表示其原因 ,所得溶液中各离子物质的量浓度由大到小的顺序为 .
③若向该氨水中加入稀盐酸,所得溶液的pH=7,则溶液中[NH4+] [Cl-](填“>”、“<”或“=”)
(2)已知某弱酸的难溶物CaA在水中存在溶解平衡:CaA(s)?Ca2++A2-△H>0,
一定温度下CaA饱和溶液中c(Ca2+)?c(A2-)为常数,记作Ksp=c(Ca2+)?c(A2-),Ksp只与温度有关.
①温度升高时,Ksp (填“增大”“减小”或“不变”,下同).
②向浊液中通入HCl气体c(Ca2+) .
③测得25℃时,CaA的Ksp为2.0×10-11,常温下将10g CaA固体投入100mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol?L-1,则溶液中c(A2-)= .
(1)①若向该氨水中加入少量氯化铵固体,NH3?H2O的电离平衡
| [OH-] |
| [NH3?H2O] |
②若向该氨水中加入稀盐酸,使其恰好完全中和,所得溶液的pH
③若向该氨水中加入稀盐酸,所得溶液的pH=7,则溶液中[NH4+]
(2)已知某弱酸的难溶物CaA在水中存在溶解平衡:CaA(s)?Ca2++A2-△H>0,
一定温度下CaA饱和溶液中c(Ca2+)?c(A2-)为常数,记作Ksp=c(Ca2+)?c(A2-),Ksp只与温度有关.
①温度升高时,Ksp
②向浊液中通入HCl气体c(Ca2+)
③测得25℃时,CaA的Ksp为2.0×10-11,常温下将10g CaA固体投入100mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol?L-1,则溶液中c(A2-)=
考点:酸碱混合时的定性判断及有关ph的计算,弱电解质在水溶液中的电离平衡,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)①氨水中存在NH3+H2O?NH3?H2O?NH4++OH-,向氨水中加入含有铵根离子或氢氧根离子的物质抑制一水合氨电离,据此判断电离平衡一定方向及
的值变化;温度不变,水的离子积常数不变;
②一水合氨和氯化氢反应生成氯化铵和水,氯化铵是强酸弱碱盐,铵根离子水解,其溶液呈酸性,然后根据铵根离子水解判断离子浓度大小;
③pH=7,溶液为中性,然后结合电荷守恒判断铵离子与氯离子浓度关系;
(2)①该反应为吸热反应,温度升高,平衡正向移动,然后判断Ksp;
②加盐酸,促进难溶盐的电离,使平衡向正反应方向移动;
③根据Ksp=c(Ca2+)×c(A2+)以及钙离子的浓度计算.
| [OH-] |
| [NH3?H2O] |
②一水合氨和氯化氢反应生成氯化铵和水,氯化铵是强酸弱碱盐,铵根离子水解,其溶液呈酸性,然后根据铵根离子水解判断离子浓度大小;
③pH=7,溶液为中性,然后结合电荷守恒判断铵离子与氯离子浓度关系;
(2)①该反应为吸热反应,温度升高,平衡正向移动,然后判断Ksp;
②加盐酸,促进难溶盐的电离,使平衡向正反应方向移动;
③根据Ksp=c(Ca2+)×c(A2+)以及钙离子的浓度计算.
解答:
解:(1)①氨水中存在NH3+H2O?NH3?H2O?NH4++OH-,向氨水中加入含有铵根离子或氢氧根离子的物质抑制一水合氨电离,所以NH3?H2O的电离平衡向左移动;
溶液中氢氧根离子浓度降低、一水合氨浓度增大,所以此时溶液中
变小,在该过程中,温度不变,则水的离子积常数Kw不变,
故答案为:向左;减小;不变;
②一水合氨和氯化氢反应生成氯化铵和水,离子反应方程式为:NH3.H2O+H+=NH4++H2O,氯化铵是强酸弱碱盐,铵根离子水解而使其溶液呈酸性,水解离子反应方程式为:NH4++H2O?NH3?H2O+H+,所以溶液的pH<7;氯离子不水解,溶液中铵根离子水解程度较小,所以离子浓度大小顺序为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:<;NH4++H2O?NH3?H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
③若向该氨水中加入稀盐酸,所得溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒可得:[NH4+]=[Cl-],
故答案为:=;
(2)①该反应为吸热反应,温度升高,平衡正向移动,Ksp增大,
故答案为:增大;
②加HCl发生反应:A2-+H+?HA-,A2-浓度减小,CaA的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积几乎不变化,所以c(Ca2+)增大,
故答案为:增大;
③已知溶液中c(Ca2+)=0.1mol/L,Ksp=c(Ca2+)×c(A2+)=2.0×10-11,则c(A2-)=
mol/L=2.0×10-10mol/L,
故答案为:2.0×10-10mol/L.
溶液中氢氧根离子浓度降低、一水合氨浓度增大,所以此时溶液中
| [OH-] |
| [NH3?H2O] |
故答案为:向左;减小;不变;
②一水合氨和氯化氢反应生成氯化铵和水,离子反应方程式为:NH3.H2O+H+=NH4++H2O,氯化铵是强酸弱碱盐,铵根离子水解而使其溶液呈酸性,水解离子反应方程式为:NH4++H2O?NH3?H2O+H+,所以溶液的pH<7;氯离子不水解,溶液中铵根离子水解程度较小,所以离子浓度大小顺序为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:<;NH4++H2O?NH3?H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
③若向该氨水中加入稀盐酸,所得溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒可得:[NH4+]=[Cl-],
故答案为:=;
(2)①该反应为吸热反应,温度升高,平衡正向移动,Ksp增大,
故答案为:增大;
②加HCl发生反应:A2-+H+?HA-,A2-浓度减小,CaA的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积几乎不变化,所以c(Ca2+)增大,
故答案为:增大;
③已知溶液中c(Ca2+)=0.1mol/L,Ksp=c(Ca2+)×c(A2+)=2.0×10-11,则c(A2-)=
| 2×10-11 |
| 0.1 |
故答案为:2.0×10-10mol/L.
点评:本题考查了酸碱混合的定性判断、弱电解质电离、难溶物溶解平衡的计算,题目难度较大,试题涉及知识点较多、综合性较强,需要弱电解质的电离特点及盐类水解特点来分析解答,注意平衡常数只与温度有关,与溶液酸碱性、离子浓度定性无关,为易错点.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
下列有关叙述正确的是( )
| A、在0.1 mol?L-1NH3?H2O溶液中:c(NH3H2O)>c(NH4+)=c(OH-)>c(H+) |
| B、0.1 mol?L-1 HCl溶液与0.1 molL-1NaOH溶液等体积混合:c(H+)+c(Na+)=c(OH-)+c(Cl-) |
| C、0.1 molL-1NaOH和0.1 mol?L-1NH4Cl溶液等体积混合后:c(Na+)=c(Cl-)>c(H+)>c(OH-) |
| D、25℃时,某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
下列有关氮及其化合物的说法不正确的是( )
| A、硝酸应保存在棕色试剂瓶里 |
| B、铵态氮肥不宜与碱性肥料混合施用 |
| C、常温下铁、铝不与浓硝酸反应 |
| D、NO可用排水法收集,NO2可用向上排空气法收集 |
乳酸 在一定条件下自身可发生缩聚反应,生成一种高聚物
在一定条件下自身可发生缩聚反应,生成一种高聚物 ,用这种新型高聚物制成的餐具,在乳酸菌的作用下,60天内可分解成无害的物质,不会对环境造成污染.在上述聚合反应中,生成的另一种产物是( )
,用这种新型高聚物制成的餐具,在乳酸菌的作用下,60天内可分解成无害的物质,不会对环境造成污染.在上述聚合反应中,生成的另一种产物是( )
 在一定条件下自身可发生缩聚反应,生成一种高聚物
在一定条件下自身可发生缩聚反应,生成一种高聚物 ,用这种新型高聚物制成的餐具,在乳酸菌的作用下,60天内可分解成无害的物质,不会对环境造成污染.在上述聚合反应中,生成的另一种产物是( )
,用这种新型高聚物制成的餐具,在乳酸菌的作用下,60天内可分解成无害的物质,不会对环境造成污染.在上述聚合反应中,生成的另一种产物是( )| A、CO2 |
| B、C2H5OH |
| C、H2O |
| D、CH3COOH |
 短周期元素T、Q、R、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等.它们的最高价氧化物的水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )
短周期元素T、Q、R、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等.它们的最高价氧化物的水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )| A、R的氧化物在空气中与其它物质作用可形成光化学烟雾 |
| B、常温下丁的浓溶液可用T单质所制的容器来盛装 |
| C、丁的浓溶液与Q的单质加热发生反应,可生成体积比为1:2的两种气体 |
| D、甲、乙、丙、丁受热均易分解 |
光导纤维被广泛应用于光缆通讯,其主要成分是( )
| A、CuO |
| B、Fe2O3 |
| C、Al2O3 |
| D、SiO2 |
以石墨层间化合物氟化石墨为正极,锂为负极,用溶有LiCI04的有机溶剂作电解质新型锂电池,能使输出电压比普通电池提高2倍,该电池具有体积小、重量轻、贮藏性好等特性.电池总反应:nLi+(CF)?nLiF+nC.则下列说法不正确的是( )
| A、放电过程中,Li+从负极区向正极区迁移 |
| B、负极反应式:nLi-ne-?nLi+ |
| C、正极反应式:(CF)n+nLi++ne-?nC+nLiF |
| D、可以用水代替有机溶剂 |
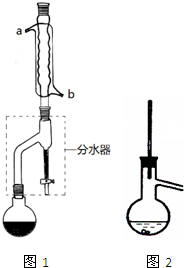 乙酸正丁酯常用作织物、人造革和塑料生产过程中的溶剂,石油和医药工业中的萃取剂,也用于香料复配以及香蕉、菠萝、杏、梨等多种香味剂的成分.实验室制备乙酸正丁酯的化学方程式为:
乙酸正丁酯常用作织物、人造革和塑料生产过程中的溶剂,石油和医药工业中的萃取剂,也用于香料复配以及香蕉、菠萝、杏、梨等多种香味剂的成分.实验室制备乙酸正丁酯的化学方程式为: