题目内容
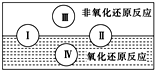 Ⅰ.已知水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用右图表达:请写出有水参加的符合反应类型Ⅳ的一个化学方程式:
Ⅰ.已知水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用右图表达:请写出有水参加的符合反应类型Ⅳ的一个化学方程式:Ⅱ.“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强.
①该过程反应的化学方程式为
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
| ||
4- 2 |
III.金属冶炼和处理常涉及氧化还原反应.
(1)由下列物质冶炼相应金属时采用电解法的是
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2═4CuSO4+2H2O,该反应的还原剂是
1mol O2发生反应时,还原剂所失电子的物质的量为
考点:氧化还原反应方程式的配平,电解原理
专题:氧化还原反应专题,电化学专题
分析:Ⅰ.由图可知,Ⅳ为氧化还原反应,且属于置换反应,以此来解答.
Ⅱ.①反应物为FeS2、氧气、水,生成物为Fe2(S04)3和硫酸,根据反应物和生成物书写化学反应方程式;
②Cu2S中Cu元素的化合价由+1升高为+2,S元素的化合价由-2升高为+6,Fe元素的化合价由+3价降低为+2,根据转移电子守恒、原子守恒配平方程式;
III.(1)金属冶炼中,活泼金属采用电解其熔融盐或氧化物的方法冶炼,Cu、Fe等较活泼金属采用热氧化还原法冶炼,不活泼金属Hg、Ag采用热分解法冶炼;
(2)该反应中Cu元素化合价由+1价变为+2价、S元素化合价由-2价变为+6价,O元素化合价由0价变为-2价,所以Cu2S是还原剂,1mol氧气发生化学反应时,有0.4molCu2S参加反应,氧化还原中得失电子数相等,根据Cu2S中元素化合价变化计算失去电子物质的量.
Ⅱ.①反应物为FeS2、氧气、水,生成物为Fe2(S04)3和硫酸,根据反应物和生成物书写化学反应方程式;
②Cu2S中Cu元素的化合价由+1升高为+2,S元素的化合价由-2升高为+6,Fe元素的化合价由+3价降低为+2,根据转移电子守恒、原子守恒配平方程式;
III.(1)金属冶炼中,活泼金属采用电解其熔融盐或氧化物的方法冶炼,Cu、Fe等较活泼金属采用热氧化还原法冶炼,不活泼金属Hg、Ag采用热分解法冶炼;
(2)该反应中Cu元素化合价由+1价变为+2价、S元素化合价由-2价变为+6价,O元素化合价由0价变为-2价,所以Cu2S是还原剂,1mol氧气发生化学反应时,有0.4molCu2S参加反应,氧化还原中得失电子数相等,根据Cu2S中元素化合价变化计算失去电子物质的量.
解答:
解:Ⅰ.由图可知,Ⅳ为氧化还原反应,且属于置换反应,如2Na+2H2O=2NaOH+H2↑,水中H元素的化合价降低,则水为氧化剂,
故答案为:2Na+2H2O=2NaOH+H2↑;
Ⅱ.①反应物为FeS、氧气、水,生成物为Fe2(S04)3和硫酸,发生反应的化学方程式为4FeS2+15O2+2H2O
2Fe2(S04)3+2H2S04,故答案为:4FeS2+15O2+2H2O
2Fe2(S04)3+2H2S04,
②Cu2S中Cu元素的化合价由+1升高为+2,S元素的化合价由-2升高为+6,Fe元素的化合价由+3价降低为+2,再据电荷守恒确定产物为H+,则该离子反应为Cu2S+10Fe3++4H2O
2Cu2++10Fe2++8H++S042-,
故答案为:1;10;4;2;10;8H+;1;
III.(1)金属冶炼中,活泼金属采用电解其熔融盐或氧化物的方法冶炼,Cu、Fe等较活泼金属采用热氧化还原法冶炼,不活泼金属Hg、Ag采用热分解法冶炼,Na是活泼金属采用电解熔融NaCl方法冶炼,Fe、Cu采用热氧化还原反应法冶炼,故选a;
(2)该反应中Cu元素化合价由+1价变为+2价、S元素化合价由-2价变为+6价,O元素化合价由0价变为-2价,所以Cu2S是还原剂、O2是氧化剂,1mol氧气发生化学反应时,有0.4molCu2S参加反应,氧化还原反应中转移电子相等,则还原剂失去电子的物质的量=0.4mol×[2×(2-1)+1×(6+2)]=4mol,故答案为:Cu2S;4.
故答案为:2Na+2H2O=2NaOH+H2↑;
Ⅱ.①反应物为FeS、氧气、水,生成物为Fe2(S04)3和硫酸,发生反应的化学方程式为4FeS2+15O2+2H2O
| ||
| ||
②Cu2S中Cu元素的化合价由+1升高为+2,S元素的化合价由-2升高为+6,Fe元素的化合价由+3价降低为+2,再据电荷守恒确定产物为H+,则该离子反应为Cu2S+10Fe3++4H2O
| ||
故答案为:1;10;4;2;10;8H+;1;
III.(1)金属冶炼中,活泼金属采用电解其熔融盐或氧化物的方法冶炼,Cu、Fe等较活泼金属采用热氧化还原法冶炼,不活泼金属Hg、Ag采用热分解法冶炼,Na是活泼金属采用电解熔融NaCl方法冶炼,Fe、Cu采用热氧化还原反应法冶炼,故选a;
(2)该反应中Cu元素化合价由+1价变为+2价、S元素化合价由-2价变为+6价,O元素化合价由0价变为-2价,所以Cu2S是还原剂、O2是氧化剂,1mol氧气发生化学反应时,有0.4molCu2S参加反应,氧化还原反应中转移电子相等,则还原剂失去电子的物质的量=0.4mol×[2×(2-1)+1×(6+2)]=4mol,故答案为:Cu2S;4.
点评:本题考查氧化还原反应,为高频考点,明确发生的反应及反应中元素的化合价变化即可解答,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
中学化学很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )
| A、根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
| B、根据同周期元素的非金属性变化趋势,推出O元素的非金属性比N元素弱 |
| C、根据主族元素最高正化合价与族序数的关系,推出氧族元素最高正价都是+6 |
| D、根据溶液的pH与溶液酸碱性的关系,推出pH=7的溶液一定显中性 |
下列离子方程式书写正确的是( )
| A、将碳与浓硫酸共热反应后的气体混合物通入过量氢氧化钠溶液中CO2+SO2+3OH-=HSO3-+CO32-+H2O |
| B、向Ca(ClO)2溶液中通入二氧化硫 Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓ |
| C、向Fe(NO3)3溶液中加入过量的HI溶液 2NO3-+8H++6I-=3I2+2NO↑+4H2O |
| D、将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合HCO3-+Ba2++OH-=BaCO3↓+H2O |
下列对金属氧化物的描述一定不正确的是( )
| A、碱性氧化物 | B、纯净物 |
| C、化合物 | D、混合物 |
下列说法中正确的是( )
| A、32 g O2占有的体积约为22.4 L |
| B、22.4 L N2含阿伏加德罗常数个氮分子 |
| C、在标准状况下,22.4 L水的质量约为18 g |
| D、22 g二氧化碳与标准状况下11.2 L HCl约含有相同的分子数 |