题目内容
配平
(1) FeS+ H2SO4═ Fe2(SO4)3+ S+ SO2+ H2O.
(2) ClO-+ Fe(OH)3+ ═ Cl-+ FeO42-+ H2O.
(3) Mn2++ ClO3-+ H2O═ MnO2↓+ Cl2↑+ .
(4) C2O42-+ MnO4-+ H+═ CO2↑+ Mn2++ H2O.
(1)
(2)
(3)
(4)
考点:氧化还原反应方程式的配平
专题:氧化还原反应专题
分析:(1)该反应中Fe元素化合价由+2价变为+3价,FeS中S元素化合价由-2价变为0价,硫酸中S元素化合价由+6价变为+4价,其转移电子总数为6,根据转移电子、原子守恒配平方程式;
(2)该反应中Cl元素化合价由+1价变为-1价、Fe元素化合价由+3价变为+6价,根据元素守恒知,该反应中反应物还有氢离子,其转移电子总数为6,根据转移电子、原子守恒配平方程式;
(3)该反应中Mn元素化合价由+2价变为+4价、Cl元素化合价由+5价变为0价,根据元素守恒知,未知生成物中含有H元素,根据电荷守恒、原子守恒、转移电子守恒确定生成物及配平方程式;
(4)该反应中C元素化合价由+3价变为+4价、Mn元素化合价由+7价变为+2价,其转移电子总数是10,根据转移电子相等、原子守恒、电荷守恒配平方程式.
(2)该反应中Cl元素化合价由+1价变为-1价、Fe元素化合价由+3价变为+6价,根据元素守恒知,该反应中反应物还有氢离子,其转移电子总数为6,根据转移电子、原子守恒配平方程式;
(3)该反应中Mn元素化合价由+2价变为+4价、Cl元素化合价由+5价变为0价,根据元素守恒知,未知生成物中含有H元素,根据电荷守恒、原子守恒、转移电子守恒确定生成物及配平方程式;
(4)该反应中C元素化合价由+3价变为+4价、Mn元素化合价由+7价变为+2价,其转移电子总数是10,根据转移电子相等、原子守恒、电荷守恒配平方程式.
解答:
解:(1)该反应中Fe元素化合价由+2价变为+3价,FeS中S元素化合价由-2价变为0价,硫酸中S元素化合价由+6价变为+4价,其转移电子总数为6,所以FeS的计量数是2、作氧化剂的H2SO4的计量数是3,再结合原子守恒配平方程式为2FeS+6H2SO4(浓)=Fe2(SO4)3+2S+3SO2↑+6H2O,
故答案为:2;6;1;2;3;6;
(2)该反应中Cl元素化合价由+1价变为-1价、Fe元素化合价由+3价变为+6价,其转移电子总数为6,则ClO-的计量数是3、Fe(OH)3的计量数是2,根据Cl、Fe原子守恒知,Cl-的计量数是3、FeO42-的计量数是2,根据电荷守恒知,反应物中未知微粒带负电荷,根据元素守恒知未知微粒含有H元素,所以应该为OH-,根据电荷守恒知,OH- 的计量数是4,再根据H原子守恒得H2O的计量数是5,所以该反应离子方程式为3ClO-+2Fe(OH)3+4OH-═3Cl-+2FeO42-+5H2O,
故答案为:3;2;4OH-;3;2;5;
(3)该反应中Mn元素化合价由+2价变为+4价、Cl元素化合价由+5价变为0价,转移电子总数是10,则Mn2+的计量数是5、ClO3-的计量数是2,根据Mn、Cl原子守恒知,MnO2、Cl2的计量数分别是5、1,根据电荷守恒、元素守恒知,未知生成物中带正电荷且含有H元素,所以为H+,根据电荷守恒知,
H+的计量数是8,再根据H原子守恒知,水分子计量数是4,所以为离子方程式为5Mn2++2ClO3-+4H2O═5MnO2↓+Cl2↑+8H+,
故答案为:5;2;4;5;1;8;
(4)该反应中C元素化合价由+3价变为+4价、Mn元素化合价由+7价变为+2价,其转移电子总数是10,
所以C2O42-的计量数是5、MnO4-的计量数是5,根据C原子守恒、Mn原子守恒知,CO2的计量数是10、Mn2+的计量数是5,根据电荷守恒知,H+的计量数是16,根据H原子守恒知,H2O的计量数是8,所以该反应离子方程式为5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8 H2O,
故答案为:5;2;16;10;2;8.
故答案为:2;6;1;2;3;6;
(2)该反应中Cl元素化合价由+1价变为-1价、Fe元素化合价由+3价变为+6价,其转移电子总数为6,则ClO-的计量数是3、Fe(OH)3的计量数是2,根据Cl、Fe原子守恒知,Cl-的计量数是3、FeO42-的计量数是2,根据电荷守恒知,反应物中未知微粒带负电荷,根据元素守恒知未知微粒含有H元素,所以应该为OH-,根据电荷守恒知,OH- 的计量数是4,再根据H原子守恒得H2O的计量数是5,所以该反应离子方程式为3ClO-+2Fe(OH)3+4OH-═3Cl-+2FeO42-+5H2O,
故答案为:3;2;4OH-;3;2;5;
(3)该反应中Mn元素化合价由+2价变为+4价、Cl元素化合价由+5价变为0价,转移电子总数是10,则Mn2+的计量数是5、ClO3-的计量数是2,根据Mn、Cl原子守恒知,MnO2、Cl2的计量数分别是5、1,根据电荷守恒、元素守恒知,未知生成物中带正电荷且含有H元素,所以为H+,根据电荷守恒知,
H+的计量数是8,再根据H原子守恒知,水分子计量数是4,所以为离子方程式为5Mn2++2ClO3-+4H2O═5MnO2↓+Cl2↑+8H+,
故答案为:5;2;4;5;1;8;
(4)该反应中C元素化合价由+3价变为+4价、Mn元素化合价由+7价变为+2价,其转移电子总数是10,
所以C2O42-的计量数是5、MnO4-的计量数是5,根据C原子守恒、Mn原子守恒知,CO2的计量数是10、Mn2+的计量数是5,根据电荷守恒知,H+的计量数是16,根据H原子守恒知,H2O的计量数是8,所以该反应离子方程式为5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8 H2O,
故答案为:5;2;16;10;2;8.
点评:本题考查氧化还原反应方程式的配平,明确元素化合价是解本题关键,再结合转移电子守恒、原子守恒、电荷守恒配平方程式,对应歧化反应先配平生成物再配平反应物,对于归一反应先配平反应物再配平生成物,注意(2)(3)缺项中微粒的确定方法,先根据转移电子守恒配平发生化合价变化的元素,再根据电荷守恒确定未知微粒,最后根据原子守恒配平方程式即可,注意多总结归纳,为学习难点.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案
相关题目
下列叙述正确的是( )
| A、相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等 |
| B、等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等 |
| C、常温常压下28 g CO与22.4 L O2所含分子数相等 |
| D、16 g CH4与18 g NH所含质子数相等 |
下列文字表述与反应方程式对应且正确的是( )
| A、溴乙烷中滴入硝酸银溶液检验其中的溴元素:Ag++Br-=AgBr↓ | ||||
| B、14g乙烯燃烧生成液态水产生b kJ热量,则表示其燃烧热的热化学方程式为:C2H4(g)+3 O2(g)═2 H2O(g)+2 CO2(g)△H=-2 b kJ?mol-1 | ||||
C、用惰性电极电解饱和KCl溶液:2 H++2 Cl-
| ||||
| D、硫酸亚铁与双氧水、稀H2SO4混合:2 Fe2++H2O2+2 H+=2 Fe3++2 H2O |
下列叙述正确的是( )
| A、稀硝酸、稀硫酸均能将木炭氧化成二氧化碳 |
| B、Na2O2与水反应、红热的Fe与水蒸气反应均生成碱 |
| C、Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物 |
| D、CO2、HCl、NH3的水溶液都能导电,它们均属于电解质 |
同温同压下,等质量的CO和CO2气体相比较,下列叙述中正确的是( )
| A、所含碳原子数比为1:1 |
| B、体积比为11:7 |
| C、密度比为7:11 |
| D、分子数比为7:11 |
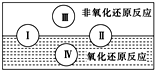 Ⅰ.已知水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用右图表达:请写出有水参加的符合反应类型Ⅳ的一个化学方程式:
Ⅰ.已知水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用右图表达:请写出有水参加的符合反应类型Ⅳ的一个化学方程式: