题目内容
中学化学很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )
| A、根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
| B、根据同周期元素的非金属性变化趋势,推出O元素的非金属性比N元素弱 |
| C、根据主族元素最高正化合价与族序数的关系,推出氧族元素最高正价都是+6 |
| D、根据溶液的pH与溶液酸碱性的关系,推出pH=7的溶液一定显中性 |
考点:元素周期表的结构及其应用,探究溶液的酸碱性
专题:
分析:A、反应进行符合复分解反应的规律;
B、同周期元素的非金属性从左到右增加,推出O元素的非金属性比N元素强;
C、氧元素一般没有正化合价;
D、溶液的酸碱性取决于c(H+)、c(OH-)相对大小.
B、同周期元素的非金属性从左到右增加,推出O元素的非金属性比N元素强;
C、氧元素一般没有正化合价;
D、溶液的酸碱性取决于c(H+)、c(OH-)相对大小.
解答:
解:A、CO2通入NaClO溶液中能生成HClO,符合复分解反应的条件,为强酸可以制取较弱酸的规律,故A正确;
B、同周期元素的非金属性从左到右增加,推出O元素的非金属性比N元素强,故B错误;
C、氧元素一般没有正化合价,氧族元素除氧元素外,其它元素最高正价是+6,故C错误;
D、溶液的酸碱性取决于c(H+)、c(OH-)相对大小,温度低于25℃,水的离子积降低,中性时c(H+)<10-7mol/L,PH>7,故D错误.
故选A.
B、同周期元素的非金属性从左到右增加,推出O元素的非金属性比N元素强,故B错误;
C、氧元素一般没有正化合价,氧族元素除氧元素外,其它元素最高正价是+6,故C错误;
D、溶液的酸碱性取决于c(H+)、c(OH-)相对大小,温度低于25℃,水的离子积降低,中性时c(H+)<10-7mol/L,PH>7,故D错误.
故选A.
点评:本题考查电离能、原子结构与性质关系、溶液酸碱性等,难度不大,注意基础知识的掌握与理解.D选项要注意溶液酸碱性溶液的酸碱性取决于c(H+)、c(OH-)相对大小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
蓝色的氮化硅硬度大、熔点高、性质稳定,根据性质推测,它不可能的用途是( )
| A、制备光导纤维 |
| B、制汽轮机叶片 |
| C、制永久性模具 |
| D、制造柴油机 |
在一定温度下,反应A2(气)+B2(气)?2AB(气)达到平衡状态的标志是( )
| A、单位时间里生成amolA2,同时消耗2amolAB |
| B、容器中的总压不随时间而变化 |
| C、A2,B2,AB浓度不随时间而变化 |
| D、v(A2):v(B2):v(AB)=1:1:2 |
 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示.则下列有关说法正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示.则下列有关说法正确的是( )| A、b点时的还原产物可能是I2 |
| B、当n(KIO3)=1.1mol时,溶液中n(I-)=0.5mol |
| C、a点时剩余NaHSO3的物质的量为1.2mol |
| D、反应过程中的氧化反应所得产物均为SO42- |
下列条件下,两瓶气体所含原子数一定相等的是( )
| A、同质量、不同密度的N2和C2H4 |
| B、同温度、同体积的H2和N2 |
| C、同体积、同密度的CO和N2 |
| D、同压强、同体积的N2O和CO2 |
下列化学用语正确的是( )
| A、氯化钙的化学式 CaCl |
B、镁离子结构示意图: |
| C、碳酸钠的电离方程式 Na2CO3=Na++CO32- |
| D、氢氧化钡的电离方程式Ba(OH)2=Ba2++2OH- |
下列有关摩尔使用的说法中不正确的是( )
| A、1mol O |
| B、1mol O2 |
| C、1mol氧分子 |
| D、1摩尔苹果 |
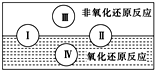 Ⅰ.已知水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用右图表达:请写出有水参加的符合反应类型Ⅳ的一个化学方程式:
Ⅰ.已知水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用右图表达:请写出有水参加的符合反应类型Ⅳ的一个化学方程式: