题目内容
下列说法中正确的是( )
| A、32 g O2占有的体积约为22.4 L |
| B、22.4 L N2含阿伏加德罗常数个氮分子 |
| C、在标准状况下,22.4 L水的质量约为18 g |
| D、22 g二氧化碳与标准状况下11.2 L HCl约含有相同的分子数 |
考点:物质的量的相关计算
专题:计算题
分析:A.氧气所处状态下的气体摩尔体积不一定是22.4L/mol;
B.氮气不一定处于标况下;
C.标况下,水为液态,22.4L水的质量远远大于18g;
D.根据n=
=
计算气体物质的量进行比较.
B.氮气不一定处于标况下;
C.标况下,水为液态,22.4L水的质量远远大于18g;
D.根据n=
| m |
| M |
| V |
| Vm |
解答:
解:A.32 g O2的物质的量为1mol,但氧气所处状态下的气体摩尔体积不一定是22.4L/mol,其占有的体积不一定是22.4L,故A错误;
B.氮气不一定处于标况下,22.4 L N2不一定为1mol,则不一定含有阿伏加德罗常数个氮分子,故B错误;
C.标况下,水为液态,密度约是1g/ml,22.4L水的质量远远大于18g,故C错误;
D.22 g二氧化碳物质的量为
=0.5mol,标准状况下11.2 L HCl物质的量为
=0.5mol,二者物质的量相等,则含有相同的分子数,故D正确,
故选D.
B.氮气不一定处于标况下,22.4 L N2不一定为1mol,则不一定含有阿伏加德罗常数个氮分子,故B错误;
C.标况下,水为液态,密度约是1g/ml,22.4L水的质量远远大于18g,故C错误;
D.22 g二氧化碳物质的量为
| 22g |
| 44g/mol |
| 11.2L |
| 22.4L/mol |
故选D.
点评:本题考查物质的量有关计算、气体摩尔体积,比较基础,注意气体摩尔体积的使用条件与对象.

练习册系列答案
相关题目
下列条件下,两瓶气体所含原子数一定相等的是( )
| A、同质量、不同密度的N2和C2H4 |
| B、同温度、同体积的H2和N2 |
| C、同体积、同密度的CO和N2 |
| D、同压强、同体积的N2O和CO2 |
反应3X(g)+Y(g)?Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.1mol,则此反应的平均速率为( )
| A、v(X)=0.03 mol/(L?min) |
| B、v(Y)=0.02 mol/(L?min) |
| C、v(Z)=0.10 mol/(L?min) |
| D、v(w)=0.20 mol/(L?min) |
在甲、乙两个密闭容器中,发生如下反应:2A(g)?B(g)+2C(s);△H=mkJ?mol-1.有如图两种图象.下列叙述正确的是( )


| A、若甲为恒容体系,图象(Ⅰ)代表温度不同时,时间与B的体积分数关系图,则m>0 |
| B、恒温条件下,图象 (Ⅰ)可能代表压强不同时,时间与B的体积分数关系图 |
| C、恒温条件下,若甲、乙两容器体积相同,起始时分别向甲中充入2molA,乙中充入1molB、3molC,则达到平衡后两容器中B的体积分数一定不同 |
| D、恒温条件下,乙容器存在图象 (Ⅱ)的关系,则当x代表压强时,y可代表B的体积分数 |
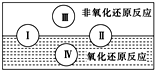 Ⅰ.已知水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用右图表达:请写出有水参加的符合反应类型Ⅳ的一个化学方程式:
Ⅰ.已知水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用右图表达:请写出有水参加的符合反应类型Ⅳ的一个化学方程式: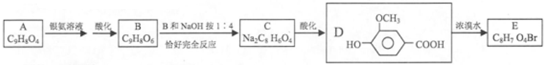
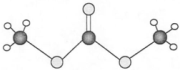
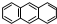 分子式C14H10)反应生成蒽醌(
分子式C14H10)反应生成蒽醌(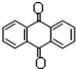 分子式C14H8O2),反应式为(未配平)C14H10(蒽)+KMnO4+H2SO4→C14H8O2(蒽醌)+K2SO4+MnSO4+H2O.
分子式C14H8O2),反应式为(未配平)C14H10(蒽)+KMnO4+H2SO4→C14H8O2(蒽醌)+K2SO4+MnSO4+H2O.