题目内容
15. 铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康.
铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康.(1)不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍.电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用的流程如图所示:
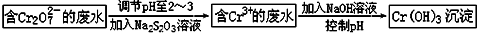
Na2S2O3在此过程中表现还原性.若向含Cr3+的废水中加入过量NaOH溶液,会得到NaCrO2溶液,NaCrO2中Cr元素的化合价为+3价,反应的离子方程式为Cr3++4OH-=CrO2-+2H2O.
(2)交警常用一种“酒精检测仪”检测司机是否酒后驾车.其反应原理如下,请配平该反应方程式:
2CrO3+3CH3CH2OH+3H2SO4-3CH3CHO+1Cr2(SO4)3+6H2O
(3)已知存在平衡:2CrO42-+2H+?Cr2O72-+H2O.向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为Cr2O72-+H2O+2Ba2+=2BaCrO4↓+2H+(任意写出其中一种即可).
此时溶液中c(Pb2+)/c(Ba2+)=2.2×10-3.
已知Ksp(BaCrO4)=1.25×10-10;Ksp(PbCrO4)=2.75×10-13
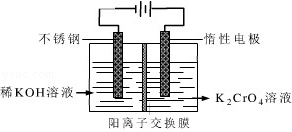
(4)工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备K2Cr2O7,制备装置如图所示(阳离子交换膜只允许阳离子透过).通电后阳极的电极反应式为2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O).请结合方程式解释反应一段时间后,在阴极室得到浓KOH溶液的原因阴极室发生反应2H2O+2e-=H2↑+2OH-,c(OH-)增大;K+穿过阳离子交换膜进入阴极室,与OH-共同得到KOH.
分析 (1)Na2S2O3与六价铬发生氧化还原反应将六价的还原成+3价,所以Na2S2O3是还原剂,NaCrO2中Cr元素的化合价为+3价,向含Cr3+的废水中加入过量NaOH溶液,反应方程式为:Cr3++4OH-=CrO2-+2H2O;
(2)该反应中Cr元素化合价由+6价变为+3价,C2H5OH中C元素化合价由-2价变为-1价,得电子的化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,其转移电子总数为6,根据转移电子相等、原子守恒配平方程式;
(3)加入Ba(NO3)2和Pb(NO3)2溶液,平衡:2CrO42-+2H+?Cr2O72-+H2O向逆反应方向移动,所以反应的离子方程式为Cr2O72-+H2O+2Ba2+=2BaCrO4↓+2H+(或Cr2O72-+H2O+2Pb2+=2PbCrO4↓+2H+,$\frac{c(P{b}^{2+})}{c(B{a}^{2+})}$=$\frac{Ksp(PbCr{O}_{4})}{Ksp(BaCr{O}_{4})}$,由此分析解答;
(4)阳极发生氧化反应,电极反应式为:2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O,阴极室发生反应2H2O+2e-=H2↑+2OH-,c(OH-)增大;K+穿过阳离子交换膜进入阴极室.
解答 解:(1)Na2S2O3与六价铬发生氧化还原反应将六价的还原成+3价,所以Na2S2O3是还原剂,NaCrO2中Cr元素的化合价为+3价,向含Cr3+的废水中加入过量NaOH溶液,反应方程式为:Cr3++4OH-=CrO2-+2H2O,故答案为:还原;+3;Cr3++4OH-=CrO2-+2H2O;
(2)该反应中Cr元素化合价由+6价变为+3价,C2H5OH中C元素化合价由-2价变为-1价,转移电子总数为6,根据转移电子相等知,CrO3的计量数是2,C2H5OH的计量数是3,再结合原子守恒配平方程式为2CrO3+3C2H5OH+3H2SO4=Cr2(SO4)3+3CH3CHO+6H2O,
故答案为:2CrO3+3CH3CH2OH+3H2SO4=3CH3CHO+1Cr2(SO4)3+6H2O;
(3)加入Ba(NO3)2和Pb(NO3)2溶液,平衡:2CrO42-+2H+?Cr2O72-+H2O向逆反应方向移动,所以反应的离子方程式为Cr2O72-+H2O+2Ba2+=2BaCrO4↓+2H+(或Cr2O72-+H2O+2Pb2+=2PbCrO4↓+2H+,$\frac{c(P{b}^{2+})}{c(B{a}^{2+})}$=$\frac{Ksp(PbCr{O}_{4})}{Ksp(BaCr{O}_{4})}$=$\frac{2.75×1{0}^{-13}}{1.25×1{0}^{-10}}$=2.2×10-3,故答案为:Cr2O72-+H2O+2Ba2+=2BaCrO4↓+2H+;2.2×10-3;
(4)阳极发生氧化反应,电极反应式为:2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O,阴极室发生反应2H2O+2e-=H2↑+2OH-,c(OH-)增大;K+穿过阳离子交换膜进入阴极室,故答案为:2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O);阴极室发生反应2H2O+2e-=H2↑+2OH-,c(OH-)增大;K+穿过阳离子交换膜进入阴极室,与OH-共同得到KOH.
点评 本题考查了难溶电解质的溶解平衡、氧化还原反应的计算以及化学方程式的书写等,沉淀溶解平衡的理解与计算,掌握基础是关键,题目难度中等.

| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、H+、CO32-、Cl- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、Fe3+、NO3-、SCN- |
| A. | 配制标准溶液的NaOH中混有Na2CO3杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其它操作正确 | |
| C. | 滴定前无气泡,滴定终了有气泡 | |
| D. | 配制标准溶液的Na0H中混有Na20杂质 |
| A. | 称取在空气中久置的碳酸钠晶体143.0g | |
| B. | 定容时,仰视观察刻度线 | |
| C. | 转移溶液时,用于溶解碳酸钠晶体的烧杯没有洗涤 | |
| D. | 定容后,将容量瓶震荡摇匀,静置时发现液面低于刻度线,于是又加少量水至刻度线 |
 以下元素均为短周期元素:
以下元素均为短周期元素:| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是 内层电子数的三倍 |
| C | 在第三周期中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.(2)D的最低价含氧酸的电子式
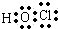 .
.(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质.该反应的化学方程式:4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C;
(5)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为CO32-+Cl2+H2O=ClO-+Cl-+HCO-3.
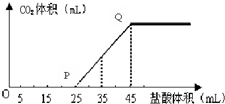
(6)A的最高价氧化物的水化物的溶液中通入一定量CO2得溶液X,X中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
①X溶液中溶质的化学式NaOH和Na2CO3.
②当加入35mL盐酸时,产生CO2的体积为224mL(标准状况).
| A. | “天宫”一号中使用的碳纤维,是一种新型无机非金属材料 | |
| B. | 氢氧化铁溶胶、雾、食盐水均能观察到丁达尔效应 | |
| C. | 盐酸、氢氧化铁胶体、汽油、橡胶均为混合物 | |
| D. | 生成盐和水的反应不一定是中和反应 |
| A. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 | |
| B. | 将草木灰和硫酸铵混合施用,肥效更高 | |
| C. | 棉花的主要成分是纤维素,石英玻璃、陶瓷和水泥均属于硅酸盐产品 | |
| D. | 硫酸工业尾气未经处理就直接排放,将直接导致“温室效应” |

| A. | a中盛浓盐酸,b中盛浓硫酸 | B. | a中盛浓硫酸,b中盛固体氯化铵 | ||
| C. | f中盛固体氯化钠和浓硫酸 | D. | f中盛固体氯化铵 |
 .
.