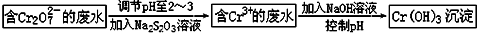题目内容
15.由葡萄糖发酵可得乳酸,酸牛奶中也能提取乳酸,纯净乳酸为无色黏稠液体,易溶于水.为了研究乳酸的分子组成和结构,进行下述实验:(1)称取乳酸0.90g,在某种状况下使其完全汽化,已知相同状况下同体积氢气为0.02g,则乳酸的相对分子质量为90.
(2)若将上述乳酸蒸气在O2中燃烧只生成CO2和H2O(g),当全部被碱石灰吸收时,碱石灰增重1.86g.若将此气体通过足量石灰水后,则石灰水会产生3.00g 白色沉淀,则乳酸的分子式为C3H6O3.
(3)乳酸分子能发生自身酯化反应,其催化氧化物不能发生银镜反应,葡萄糖发酵只生成乳酸,试写出葡萄糖生成乳酸的化学方程式:CH2OH(CHOH)4CHO→2CH3CH(OH)COOH.
(4)写出乳酸在催化剂作用下发生反应,生成分子式为C6H8O4的环状酯的结构简式:
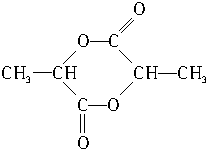 .
.
分析 (1)同温同压下,气体密度之比等于其相对分子质量之比,由气体体积相等可推出:$\frac{{{M_{r_1}}}}{{{M_{r_2}}}}=\frac{m_1}{m_2}$;
(2)生成白色沉淀为碳酸钙,根据碳原子守恒计算二氧化碳的物质的量,碱石灰增重为二氧化碳与水的质量,计算生成水的物质的量,根据原子守恒确定分子中C、H原子数目,结合相对分子质量计算确定O原子数目,进而确定弱酸的分子式;
(3)乳酸分子能发生自身酯化反应,含有-COOH、-OH,其催化氧化物不能发生银镜反应,说明-OH连接的C原子是只含有一个H原子,结合分子式确定弱酸的结构简式;
(4)乳酸发生酯化反应生成环酯.
解答 解:(1)同温同压下,气体密度之比等于其相对分子质量之比,由气体体积相等可推出:$\frac{{{M_{r_1}}}}{{{M_{r_2}}}}=\frac{m_1}{m_2}$,故弱酸的相对分子质量为2×$\frac{0.9}{0.02}$=90,故答案为:90;
(2)0.9g弱酸的物质的量为0.01 mol,完全燃烧生成CO2 为$\frac{3g}{100g/mol}$=0.03 mol,生成H2O为$\frac{{1.86g-0.03mol×44g•mo{l^{-1}}}}{{18g•mo{l^{-1}}}}$=0.03mol,所以一个乳酸分子中有3个碳原子和6个H原子,又因其相对分子质量为90,故含氧原子数为$\frac{90-3×12-6}{16}$=3,所以乳酸的分子式为C3H6O3,
故答案为:C3H6O3;
(3)乳酸分子能发生自身酯化反应,含有-COOH、-OH,其催化氧化物不能发生银镜反应,说明-OH连接的C原子是只含有一个H原子,乳酸的结构简式为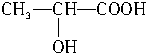 ,故葡萄糖发酵生成乳酸的化学方程式为:CH2OH(CHOH)4CHO→2CH3CH(OH)COOH,
,故葡萄糖发酵生成乳酸的化学方程式为:CH2OH(CHOH)4CHO→2CH3CH(OH)COOH,
故答案为:CH2OH(CHOH)4CHO→2CH3CH(OH)COOH;
(4)乳酸在催化剂作用下发生反应,生成分子式为C6H8O4的环状酯的结构简式: ,
,
故答案为: .
.
点评 本题考查有机物分子式与结构的确定,掌握燃烧法利用原子守恒确定有机物分子式方法,掌握官能团的性质与转化.

 阅读快车系列答案
阅读快车系列答案| A. | 分子数 | B. | 原子数 | C. | 质子数 | D. | 电子数 |
| A. | 某无色透明的溶液中:Ca2+、NH4+、CO32-、HCOO- | |
| B. | 溶解有AlCl3的溶液中:Na+、K+、SO42-、S2- | |
| C. | 25℃时,水电离出的c(H+)=1×l0-l3mol/L的溶液中:K+、Ba2+、NO3-、I- | |
| D. | 离子浓度均为0.1mol/L的溶液中:Na+、Fe3+、CH3COO-、NO3- |
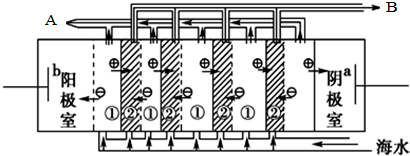 ,电渗阴极室可获得的重要化工原料有氢气、氢氧化钠.
,电渗阴极室可获得的重要化工原料有氢气、氢氧化钠.(2)海水中含有大量的NaCl,盐田法仍是目前海水制盐的主要方法.盐田分为贮水池、蒸发 池和结晶池,建盐田必须在BC处建立(填序号).
A.选在离江河入海口比较近的地方
B.多风少雨
C.潮汐落差大且又平坦空旷的海滩
(3)盐田中所得为粗盐,若想用粗盐制烧碱,需对所用食盐水进行两次精制.第一次精制主要是用沉淀法除去粗盐水中的Ca2+、Mg2+、Fe2+、SO42-等离子,流程如下:
粗盐水$→_{过程Ⅰ}^{过量BaCl_{2}溶液}$$→_{过程Ⅱ}^{过量Na_{2}CO_{3}溶液}$$→_{过程Ⅲ}^{过量NaOH溶液}$$→_{过程Ⅳ}^{过滤}$滤液$→_{调pH}^{盐酸}$第一次精制食盐水
已知:20℃部分沉淀的溶解度(g)如表
| CaSO4 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②运用表中数据解释过程I选用BaCl2而不选用CaCl2的原因BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全.
(4)工业上通常以NaCl、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl.
样品m克$→_{溶解}^{H_{2}O}$溶液$→_{过滤}^{过量BaCl_{2}溶液}$沉淀$→_{洗涤}^{H_{2}O}$$\stackrel{低温烘干、冷却、称量}{→}$固体n克
(5)工业制得的纯碱常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数.样品中NaCl质量分数的数学表达式为(1-$\frac{106n}{197m}$)×100%.
| A. |  Al(OH)3 | B. |  C6H12O6 | C. |  CH3CH2OH | D. |  NaHCO3 |
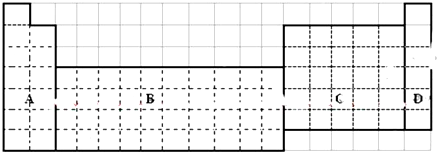
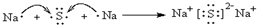 .
.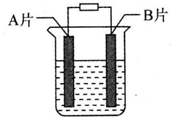 【实验目的】利用所学知识,设计原电池装置.
【实验目的】利用所学知识,设计原电池装置.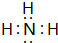 ,请用电子式表示A与C形成化合物的过程
,请用电子式表示A与C形成化合物的过程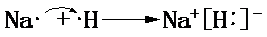 .
.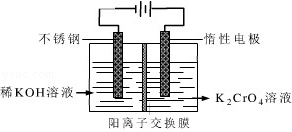 铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康.
铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康.