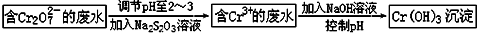题目内容
16.水溶液中能大量共存的一组离子是( )| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、H+、CO32-、Cl- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、Fe3+、NO3-、SCN- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能结合生成络离子等,则离子大量共存,以此来解答.
解答 解:A.Ca2+、SO42-结合生成沉淀,不能共存,故A错误;
B.H+、CO32-结合生成水和气体,Fe2+、CO32-结合生成沉淀,不能共存,故B错误;
C.该组离子之间不反应,可大量共存,故C正确;
D.Fe3+、SCN-结合生成络离子,不能共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应、络合反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
6.下列离子在给定条件下,可能大量共存的是( )
| A. | 某无色透明的溶液中:Ca2+、NH4+、CO32-、HCOO- | |
| B. | 溶解有AlCl3的溶液中:Na+、K+、SO42-、S2- | |
| C. | 25℃时,水电离出的c(H+)=1×l0-l3mol/L的溶液中:K+、Ba2+、NO3-、I- | |
| D. | 离子浓度均为0.1mol/L的溶液中:Na+、Fe3+、CH3COO-、NO3- |
16.设NA为阿伏加德罗常数的值.下列说法不正确的是( )
| A. | 常温常压下,2gD2O中含有的电子总数为NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 1mol K与足量O2反应,生成K2O、K2O2和KO2的混合物时转移的电子数为NA | |
| D. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为10-13NA |
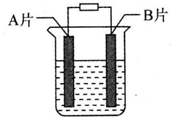 【实验目的】利用所学知识,设计原电池装置.
【实验目的】利用所学知识,设计原电池装置.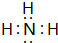 ,请用电子式表示A与C形成化合物的过程
,请用电子式表示A与C形成化合物的过程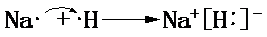 .
.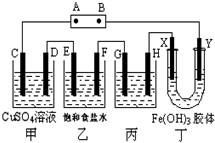 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
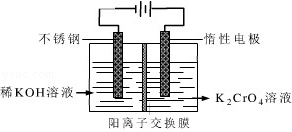 铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康.
铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康.