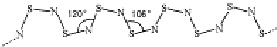题目内容
16.用浓硫酸配制一定物质的量浓度的稀硫酸溶液,下列操作对所得溶液浓度的影响是:①用量筒量取浓硫酸时,俯视读数偏大(选填“偏大”“偏小”或“无影响”,下同);
②浓硫酸稀释后未冷却到室温就注入容量瓶定容偏大;
③定容时,俯视刻度线偏大;
④配制好的溶液转移入试剂瓶时,部分液体迸溅偏小.
分析 分析操作对溶质的物质的量n和溶液体积V的影响,依据$\frac{n}{V}$凡是使n偏小或者使V偏大的操作,都会导致溶液浓度偏低,反之导致溶液浓度偏高.
解答 解:①用量筒量取浓硫酸时,俯视读数,导致溶液体积偏小,所配溶液浓度偏大;
②浓硫酸稀释后未冷却到室温就注入容量瓶定容,冷却后,溶液体积偏小,所配溶液浓度偏大;
③定容时,俯视刻度线,导致溶液体积偏小,溶液浓度偏大;
④配制好的溶液转移入试剂瓶时,部分液体迸溅,导致溶质的物质的量偏小,溶液浓度偏小;
故答案为:偏大;偏大;偏大;偏小.
点评 本题考查了一定物质的量浓度溶液的配制误差分析,依据C=$\frac{n}{V}$,准确把握操作对溶质的物质的量和溶液体积的影响是解题关键,题目难度不大.

练习册系列答案
相关题目
10.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 高温下,16.8g Fe与足量水蒸气完全反应失去电子数为0.8NA | |
| B. | 一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3NA | |
| C. | 1.8g重水(D2O)中含有的质子数和电子数均为NA | |
| D. | 标准状况下,22.4L NO 和22.4L O2混合后所得气体中分子总数为1.5NA |
1.既能发生加成反应、酯化反应,又能发生氧化反应的有机物是( )
| A. | CH2=CH3 | B. | CH2=CH-CH2OH | C. | CH3=CH-COOH | D. | CH2=CH-COOCH3 |
8.下列离子方程式书写正确的是( )
| A. | 稀盐酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 石灰石上滴加稀盐酸:CaCO3+2H+═Ca2++H2CO3 | |
| D. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
5.下列化学用语正确的是( )
| A. | Cl-的结构示意图: | |
| B. | 乙酸的结构示意图:C2H4O2 | |
| C. | 硫酸的电离方程式:H2SO4═H2++SO42- | |
| D. | 氯化钠的电子式: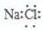 |
6.FeS2与HNO3反应后的氧化产物为Fe(NO3)3 和H2SO4,若反应中FeS2与HNO3的物质的量之比为1:8,HNO3的还原产物为( )
| A. | NO2 | B. | NO | C. | N2 O | D. | N2O3 |
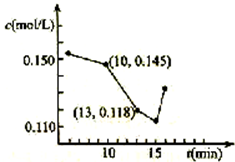 对低品位的菱镁矿(主要成份是MgCO3和CaCO3)的综合利用意义重大.矿石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应的化学方程式如下:
对低品位的菱镁矿(主要成份是MgCO3和CaCO3)的综合利用意义重大.矿石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应的化学方程式如下: ,其中S原子轨道的杂化类型是sp3,它是极性(填“极性”或“非极性”)分子.
,其中S原子轨道的杂化类型是sp3,它是极性(填“极性”或“非极性”)分子.