题目内容
10.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 高温下,16.8g Fe与足量水蒸气完全反应失去电子数为0.8NA | |
| B. | 一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3NA | |
| C. | 1.8g重水(D2O)中含有的质子数和电子数均为NA | |
| D. | 标准状况下,22.4L NO 和22.4L O2混合后所得气体中分子总数为1.5NA |
分析 A、求出铁的物质的量,然后根据铁与水蒸气反应后变为+$\frac{8}{3}$价来分析;
B、铁粉的物质的量不明确;
C、重水的摩尔质量为20g/mol;
D、一氧化氮与氧气反应生成二氧化氮,二氧化氮与四氧化二氮之间存在转化平衡,所以反应后的物质中含有的分子数减小;
解答 解:A、16.8g铁的物质的量为0.3mol,而铁与水蒸气反应后变为+$\frac{8}{3}$价,故0.3mol铁失去0.8mol电子即0.8NA个,故A正确;
B、铁粉的物质的量不明确,故转移的电子数无法计算,故B错误;
C、重水(D2O)的相对分子质量为20,1.8 g重水(D2O)的物质的量为0.09mol,含有的质子数和电子数均为0.9NA,故C错误;
D、根据2NO+O2═2NO2可知:标准状况下,22.4 L NO即1molNO 和22.4 L O2 即1mol氧气混合后所得气体的物质的量为1.5mol,但由于NO2气体中存在平衡:2NO2?N2O4,导致分子总数小于1.5 NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.在反应2KClO3═2KCl+3O2↑中,生成1mol O2转移电子数是( )
| A. | 6NA | B. | 12 NA | C. | 2 NA | D. | 4 NA |
18.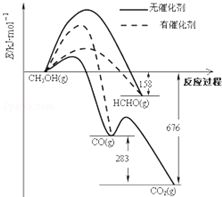 (1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图(反应物O2(g)和生成物H2O(g)略去).
(1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图(反应物O2(g)和生成物H2O(g)略去).
①在有催化剂作用下,CH3OH与O2反应主要生成HCHO;(填“CO、CO2”或“HCHO”)
②2HCHO(g)+O2(g)═2CO(g)+2H2O(g)△H=-470KJ•mol-1;
(2)已知:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ•mol-1.
经测定不同温度下该反应的平衡常数如表:
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4mol•L-1、c(H2)=0.4mol•L-1、c(CH3OH)=0.8mol•L-1,则此时V正<V逆(填“>”、“<”或“=”).
 (1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图(反应物O2(g)和生成物H2O(g)略去).
(1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图(反应物O2(g)和生成物H2O(g)略去).①在有催化剂作用下,CH3OH与O2反应主要生成HCHO;(填“CO、CO2”或“HCHO”)
②2HCHO(g)+O2(g)═2CO(g)+2H2O(g)△H=-470KJ•mol-1;
(2)已知:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ•mol-1.
经测定不同温度下该反应的平衡常数如表:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
5.热化学方程式C(s)+H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$CO(g)+H2(g);△H=+131.3kJ/mol表示( )
| A. | 碳和水反应吸收131.3kJ能量 | |
| B. | 1mol碳和1mol水反应生成 一氧化碳和氢气,并吸收131.3kJ热量 | |
| C. | 1mol C(S)和1 mol H2O(g)的能量总和大于1mol H2(g)和1mol CO(g)的能量 | |
| D. | 1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ |
2.现有下列试剂:①氯水 ②Br2水 ③碘水 ④O3 ⑤NO2 ⑥稀硝酸,其中能使淀粉碘化钾溶液变蓝的是( )
| A. | ①②⑥ | B. | ④⑤ | C. | 除③外 | D. | 全部 |
19.将BaO2放入密闭真容器中,反应2BaO2(s)?2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
| A. | 平衡常数减小 | B. | BaO量不变 | C. | 氧气压强不变 | D. | 氧气的浓度变大 |

 ;
; ;
; 、
、 、
、 、
、 (其中任意两种).
(其中任意两种).