题目内容
6.FeS2与HNO3反应后的氧化产物为Fe(NO3)3 和H2SO4,若反应中FeS2与HNO3的物质的量之比为1:8,HNO3的还原产物为( )| A. | NO2 | B. | NO | C. | N2 O | D. | N2O3 |
分析 根据题给信息知,FeS2和HNO3的反应中生成硝酸铁、硫酸和氮氧化物,根据氧化还原反应中得失电子数相等确定氮氧化物的化学式.
解答 解:根据题给信息知,FeS2和HNO3的反应中生成硝酸铁、硫酸和氮氧化物,FeS2和HNO3的物质的量之比是1:8,
设二者的物质的量分别为1mol、8mol,
由质量守恒可知生成1molFe(NO3)3、2molH2SO4,
则起酸作用的硝酸为3mol,所以作氧化剂的硝酸为5mol,
反应共失去电子的物质的量为1mol×(3-2)+2mol×[6-(-1)]=15mol,
设氮氧化物中N元素的化合价是X,则得到的电子总数=(5-x)×5=15,所以x=2,即氮氧化物的化学式为NO,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,明确元素化合价是解本题的关键,注意从得失电子数目相等角度解答该题,难度不大.

练习册系列答案
 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
17.向CuSO4和Fe2(SO4)3的混合溶液中加入一定质量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无明显现象,下列叙述中正确的是( )
| A. | 滤液中一定有Cu2+ | B. | 滤液中一定无Cu2+ | ||
| C. | 滤液中一定有Fe3+ | D. | 滤液中一定无Fe3+ |
14.修正液(俗称涂改液)白色纯正、反射率高且使用方便,复印时常用于对文稿的修改.目前有许多中小学生使用修正液,用于修改笔记、作业等.由于修正液中含有挥发性的有毒溶剂,教师应告诫学生不要使用.修正液中所含的有毒成分可能是( )
| A. | 乙醇 | B. | 醋酸 | C. | 一氯甲烷 | D. | 三氯乙烯 |
18.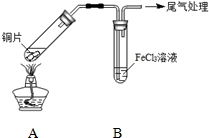 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验.
FeCl3溶液显酸性的原因是Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3+3H+.写出装置A中产生SO2的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
【查阅资料】Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+.生成Fe(HSO3)2+离子的反应为可逆反应.
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:H2O+SO2=H2SO3、H2SO3$\stackrel{△}{?}$H++HSO3-、Fe3++HSO3-$\stackrel{△}{?}$Fe(HSO3)2+.
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验.
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为生成蓝色沉淀.
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验.
| 步骤① | 配制1mol•L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A. |
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
【查阅资料】Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+.生成Fe(HSO3)2+离子的反应为可逆反应.
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:H2O+SO2=H2SO3、H2SO3$\stackrel{△}{?}$H++HSO3-、Fe3++HSO3-$\stackrel{△}{?}$Fe(HSO3)2+.
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验.
| 步骤② | 往5mL 1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
15.下列有关金属及其化合物的说法正确的是( )
| A. | MgO和Al2O3均只能与酸反应,不能与碱反应 | |
| B. | Na和Fe在一定条件下与水反应都生成H2和对应的碱 | |
| C. | Mg和Al都可以用电解法冶炼得到 | |
| D. | Na2O和Na2O2与CO2反应产物相同 |
16.在体积固定的密闭容器中,发生2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)反应,下列叙述能说明该反应达到化学平衡状态的是( )
| A. | 混合气体的密度不变 | B. | 混合气体的平均相对分子质量不变 | ||
| C. | v正(CO)=2v逆(H2) | D. | CO(g)、CH3CH2OH(g)的分子数之比为2:1 |

 、G
、G .
. .
.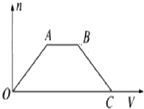 将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图,图中AB段表示的离子方程式是( )
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图,图中AB段表示的离子方程式是( )