题目内容
1. 发展煤的液化技术被纳入“十二五”规划,中科院山西煤化所有关煤液化技术的高效
发展煤的液化技术被纳入“十二五”规划,中科院山西煤化所有关煤液化技术的高效催化剂研发项目取得积极进展.已知:煤可以先转化为一氧化碳和氢气,再在催化剂
作用下合成甲醇(CH3OH),从而实现液化.
①某含铜的离子结构如图所示:在该离子内部微粒间作用力的类型有b、c、d.
a.离子键 b.极性键 c.非极性键
d.配位键 e.范德华力 f.氢键)(填字母)
②煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛(HCHO),甲醇的沸点64.96℃,甲醛的沸点-21℃,甲醇的沸点更高的原因是因为分子间存在着氢键,甲醛分子间没有氢键,但是甲醇和甲醛均易溶于水,原因是它们均可以和水分子间形成氢键.请你说明甲醛分子间没有氢键原因甲醛分子中氢原子与碳原子形成共价键,碳的电负性较小,不构成形成氢键的条件(或甲醛分子中的氢不够活泼、不够显电正性等).;
③甲醇分子中进行sp3杂化的原子有C、O;甲醛与H2发生加成反应,当生成1mol甲醇,断裂σ键的数目为NA.
分析 ①根据含铜的离子的结构图分析,Cu与N元素间形成配位键,C与N之间形成极性键,C与C之间形成非极性键;
②根据形成氢键的条件分析,氢键是分子间作用力的一种,F、O、N的电负性较强,对应的氢化物分子之间能形成氢键;
③利用甲醇中的成键来分析原子的杂化类型;利用判断σ键的规律来分析σ键数目.
解答 解:①根据含铜的离子的结构图分析可知,Cu与N元素间形成配位键,C与N之间形成极性键,C与C之间形成非极性键;
故答案为:b、c、d;
②电负性较强的元素如N、O、F与H形成共价键时,能形成氢键,而C的电负性较弱,与H形成共价键后,不能形成氢键,(或甲醛分子中的氢不够活泼、不够显电正性等),
故答案为:甲醛分子中氢原子与碳原子形成共价键,碳的电负性较小,不构成形成氢键的条件(或甲醛分子中的氢不够活泼、不够显电正性等);
③甲醇分子中C原子形成4个单键,即C含有4个σ键电子对,所以是sp3杂化,甲醇中O含有2个4个σ键电子对和2个孤电子对,所以O原子为sp3杂化;甲醛中含有一个C=O,C=O由1个π键和1个σ键构成,所以甲醛与H2发生加成反应,当生成1mol甲醇,断裂σ键的数目为NA,
故答案为:C、O; NA.
点评 本题考查了元素的推断,涉及氢键、化学键的判断、杂化等,注意把握杂化轨道理论高频考点的熟练应用,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列说法正确的是( )
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 铝在高温下能还原锰、铁、铬等金属氧化物得到金属 | |
| C. | 点燃的镁条插入盛有N2的集气瓶中,立即熄灭 | |
| D. | 因为镁和铝在空气中都能形成氧化膜,所以镁铝都不能溶于浓硝酸 |
9.用NA表示阿伏加德罗常数,下列关于0.2mol•L-1K2SO4溶液的正确说法是( )
| A. | 1 L溶液中K+浓度是0.4 mol•L-1 | |
| B. | 溶液中含有0.4NA个K+ | |
| C. | 1 L溶液中所含K+、SO42-总数为0.3NA | |
| D. | 2 L溶液中SO42-浓度是0.4 mol•L-1 |
6.某小组对Cu与浓HNO3的反应进行研究.记录如下:
I.Cu与浓HNO3反应的化学方程式是Cu+4HN03(浓)═Cu(NO3)2+2NO2↑+2H20.
II.探究实验1中溶液A呈绿色而不是蓝色的原因溶液A和溶液B中,c(Cu2+) 基本相同.
(1)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的.乙根据实验记录,认为此观点不正确,乙的依据是溶液A和溶液B中,c(Cu2+) 基本相同.
(2)乙认为溶液呈绿色是由溶解的NO2引起的.进行实验2:先将NO2通入B中,再鼓入N2.结果证实假设成立.则以上两步操作对应的现象分别是、溶液由蓝变绿;溶液由绿变蓝,有红棕色气体逸出.
(3)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的、浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色.
ii.NO2溶于水,会发生反应2NO2+H2O=HNO3+HNO2HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解.
iii.NO-2能与Cu2+反应:Cu2+(蓝色)+4NO2-═Cu(NO2)42-(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了Cu(NO2)2-4使溶液呈绿色.
丙进行如下实验:
①亚硝酸分解的化学方程式是3HNO2═HNO3+2NO↑+H2O.
②请用平衡原理解释加入稀H2SO4后绿色溶液变蓝的原因:加入稀硫酸,抑制HNO2的电离,并使HNO2分解,降低c(NO2-),造成 Cu2+(蓝色)+4NO2-?Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色.
(4)根据实验得出结论:实验l中溶液A呈绿色的主要原因是A中剩余的浓 HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2 的蓝色溶液混合而形成的绿色,请依据实验现象阐述理由:实验4中加稀硫酸,溶液变为蓝色,说明酸性较强的A溶液中 NO2-不能大量存在,因此在A溶液中,绿色的Cu(NO2)42-不能大量存在,Cu2+与NO2-反应生成Cu(NO2)42- 不是使溶液呈绿色的主要原因.
| 装置 | 药品 | 现象 | |
| 实验1 |  | 0.64g Cu片(0.01mol)和20.0mL浓HNO3 | Cu片消失,得到绿色溶液A,放置较长时间后得到蓝色溶液B,… |
II.探究实验1中溶液A呈绿色而不是蓝色的原因溶液A和溶液B中,c(Cu2+) 基本相同.
(1)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的.乙根据实验记录,认为此观点不正确,乙的依据是溶液A和溶液B中,c(Cu2+) 基本相同.
(2)乙认为溶液呈绿色是由溶解的NO2引起的.进行实验2:先将NO2通入B中,再鼓入N2.结果证实假设成立.则以上两步操作对应的现象分别是、溶液由蓝变绿;溶液由绿变蓝,有红棕色气体逸出.
(3)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的、浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色.
ii.NO2溶于水,会发生反应2NO2+H2O=HNO3+HNO2HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解.
iii.NO-2能与Cu2+反应:Cu2+(蓝色)+4NO2-═Cu(NO2)42-(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了Cu(NO2)2-4使溶液呈绿色.
丙进行如下实验:
| 操作 | 现象 | |
| 实验3 | i.配制与溶液A的c(H+)相同的HNO3溶液,取20.0mL,通入NO2气体 | 溶液呈黄色 |
| ii.再加0.01mol Cu(NO3)2固体搅拌至完全溶解 | 溶液变为绿色 | |
| 3、加水稀释 | 溶液立即变为蓝色 | |
| 实验4 | i.向20.0mL 0.5mol/L Cu(NO3)2蓝色溶液中通入少量NO2 | 溶液呈绿色 |
| ii.加入稀H2SO4 | 有无色气体放出,遇空气变红棕色,溶液很快变为蓝色 |
②请用平衡原理解释加入稀H2SO4后绿色溶液变蓝的原因:加入稀硫酸,抑制HNO2的电离,并使HNO2分解,降低c(NO2-),造成 Cu2+(蓝色)+4NO2-?Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色.
(4)根据实验得出结论:实验l中溶液A呈绿色的主要原因是A中剩余的浓 HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2 的蓝色溶液混合而形成的绿色,请依据实验现象阐述理由:实验4中加稀硫酸,溶液变为蓝色,说明酸性较强的A溶液中 NO2-不能大量存在,因此在A溶液中,绿色的Cu(NO2)42-不能大量存在,Cu2+与NO2-反应生成Cu(NO2)42- 不是使溶液呈绿色的主要原因.
10.下列物质的水溶液能导电,但该物质属于非电解质的是( )
| A. | Cu | B. | CO2 | C. | NH3 | D. | CH3CH2OH(乙醇) |
4.从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如图:
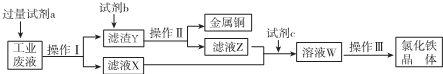
则下列说法正确的是( )

则下列说法正确的是( )
| A. | 试剂a是铁、试剂b是稀硫酸 | |
| B. | 操作I、操作Ⅱ、操作Ⅲ所用仪器相同 | |
| C. | 试剂c可以是H2O2溶液或氯气 | |
| D. | 用酸性KMnO4溶液可检验溶液W中是否还有Fe2+ |


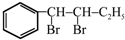



 与BrMgCH2(CH2)3CH2MgBr在一定条件下发生类似反应①的反应,生成的有机化合物Ⅵ(分子式为C16H17N)的结构简式为
与BrMgCH2(CH2)3CH2MgBr在一定条件下发生类似反应①的反应,生成的有机化合物Ⅵ(分子式为C16H17N)的结构简式为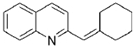 .
.