题目内容
6.某小组对Cu与浓HNO3的反应进行研究.记录如下:| 装置 | 药品 | 现象 | |
| 实验1 |  | 0.64g Cu片(0.01mol)和20.0mL浓HNO3 | Cu片消失,得到绿色溶液A,放置较长时间后得到蓝色溶液B,… |
II.探究实验1中溶液A呈绿色而不是蓝色的原因溶液A和溶液B中,c(Cu2+) 基本相同.
(1)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的.乙根据实验记录,认为此观点不正确,乙的依据是溶液A和溶液B中,c(Cu2+) 基本相同.
(2)乙认为溶液呈绿色是由溶解的NO2引起的.进行实验2:先将NO2通入B中,再鼓入N2.结果证实假设成立.则以上两步操作对应的现象分别是、溶液由蓝变绿;溶液由绿变蓝,有红棕色气体逸出.
(3)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的、浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色.
ii.NO2溶于水,会发生反应2NO2+H2O=HNO3+HNO2HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解.
iii.NO-2能与Cu2+反应:Cu2+(蓝色)+4NO2-═Cu(NO2)42-(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了Cu(NO2)2-4使溶液呈绿色.
丙进行如下实验:
| 操作 | 现象 | |
| 实验3 | i.配制与溶液A的c(H+)相同的HNO3溶液,取20.0mL,通入NO2气体 | 溶液呈黄色 |
| ii.再加0.01mol Cu(NO3)2固体搅拌至完全溶解 | 溶液变为绿色 | |
| 3、加水稀释 | 溶液立即变为蓝色 | |
| 实验4 | i.向20.0mL 0.5mol/L Cu(NO3)2蓝色溶液中通入少量NO2 | 溶液呈绿色 |
| ii.加入稀H2SO4 | 有无色气体放出,遇空气变红棕色,溶液很快变为蓝色 |
②请用平衡原理解释加入稀H2SO4后绿色溶液变蓝的原因:加入稀硫酸,抑制HNO2的电离,并使HNO2分解,降低c(NO2-),造成 Cu2+(蓝色)+4NO2-?Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色.
(4)根据实验得出结论:实验l中溶液A呈绿色的主要原因是A中剩余的浓 HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2 的蓝色溶液混合而形成的绿色,请依据实验现象阐述理由:实验4中加稀硫酸,溶液变为蓝色,说明酸性较强的A溶液中 NO2-不能大量存在,因此在A溶液中,绿色的Cu(NO2)42-不能大量存在,Cu2+与NO2-反应生成Cu(NO2)42- 不是使溶液呈绿色的主要原因.
分析 Ⅰ(1)硝酸具有强氧化性,可与铜反应生成硝酸铜和二氧化氮气体;
Ⅱ.(1)乙的依据是 溶液A和溶液B中,c(Cu2+) 基本相同;(2)乙认为溶液呈绿色是由溶解的NO2引起的,若假设成立,则先将NO2通入B中,再鼓入N2,以上两步操作对应的现象分别是溶液由蓝变绿、溶液由绿变蓝,有红棕色气体逸出;
(3)①根据加入稀H2SO4有无色气体放出,遇空气变红棕色,可知有一氧化氮生成,则亚硝酸歧化分解;
②加入稀H2SO4后绿色溶液变蓝的原因:加入稀硫酸,抑制HNO2的电离,并使HNO2分解,降低c(NO2-),造成 Cu2+(蓝色)+4NO2-?Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色;
(4)根据实验对比得出结论:实验l中溶液A呈绿色的主要原因是 A中剩余的浓 HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2 的蓝色溶液混合而形成的绿色;理由:实验4中加稀硫酸,溶液变为蓝色,说明酸性较强的A溶液中 NO2-不能大量存在,因此在A溶液中绿色的Cu(NO2)42-不能大量存在,Cu2+与NO2-反应生成Cu(NO2)42- 不是使溶液呈绿色的主要原因.
解答 解:Ⅰ(1)硝酸具有强氧化性,可与铜反应生成硝酸铜和二氧化氮气体,反应方程式为Cu+4HN03(浓)═Cu(NO3)2+2NO2↑+2H20,
故答案为:Cu+4HN03(浓)═Cu(NO3)2+2NO2↑+2H20;
Ⅱ.(1)乙的依据是 溶液A和溶液B中,c(Cu2+) 基本相同,故答案为:溶液A和溶液B中,c(Cu2+) 基本相同;
(2)乙认为溶液呈绿色是由溶解的NO2引起的,若假设成立,则先将NO2通入B中,再鼓入N2,以上两步操作对应的现象分别是溶液由蓝变绿、溶液由绿变蓝,有红棕色气体逸出,故答案为:溶液由蓝变绿;溶液由绿变蓝,有红棕色气体逸出;
(3)①根据加入稀H2SO4有无色气体放出,遇空气变红棕色,可知有一氧化氮生成,则亚硝酸歧化分解的化学方程式是 3HNO2═HNO3+2NO↑+H2O,故答案为:3HNO2═HNO3+2NO↑+H2O;
②加入稀H2SO4后绿色溶液变蓝的原因:加入稀硫酸,抑制HNO2的电离,并使HNO2分解,降低c(NO2-),造成 Cu2+(蓝色)+4NO2-?Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色,故答案为:加入稀硫酸,抑制HNO2的电离,并使HNO2分解,降低c(NO2-),造成 Cu2+(蓝色)+4NO2-?Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色;
(4)根据实验得出结论:实验l中溶液A呈绿色的主要原因是 A中剩余的浓 HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2 的蓝色溶液混合而形成的绿色;依据实验现象阐述理由:实验4中加稀硫酸,溶液变为蓝色,说明酸性较强的A溶液中 NO2-不能大量存在,因此在A溶液中,绿色的Cu(NO2)42-不能大量存在,Cu2+与NO2-反应生成Cu(NO2)42- 不是使溶液呈绿色的主要原因,故答案为:A中剩余的浓 HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2 的蓝色溶液混合而形成的绿色;实验4中加稀硫酸,溶液变为蓝色,说明酸性较强的A溶液中 NO2-不能大量存在,因此在A溶液中,绿色的Cu(NO2)42-不能大量存在,Cu2+与NO2-反应生成Cu(NO2)42- 不是使溶液呈绿色的主要原因.
点评 本题主要考查HNO3的性质、属物质验证性实验设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,利用对比的方法判断硝酸的性质,物质验证性实验方案的设计如下:结合已知的物质具有的性质,选择合适的试剂,设计具体实验方案验证物质是否具有该性质.对有毒气体要设计尾气处理装置,防止污染环境.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案| A. | 非金属性:P<S<Cl | B. | 氢化物稳定性:HF>H2S>H2O | ||
| C. | 碱性:Mg(OH)2>NaOH>Ca(OH)2 | D. | 原子半径:F>Cl>Br>I |
| A. | 双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | |
| B. | 在100 mL 2 mol/L FeBr2溶液中通入4.48 L氯气(标况下),充分反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32-+H2O?HCO3-+OH- | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
| A. | 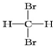 和 和 互为同分异构体 互为同分异构体 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,能说明侧链对苯环性质有影响 | |
| C. | 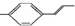 分子中所有碳原子可能都共面 分子中所有碳原子可能都共面 | |
| D. | 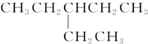 的核磁共振氢谱有5个峰 的核磁共振氢谱有5个峰 |
| A. | C4H10 | B. | C4H4Cl2 | C. | CH2Cl2 | D. | C5H12 |
 发展煤的液化技术被纳入“十二五”规划,中科院山西煤化所有关煤液化技术的高效
发展煤的液化技术被纳入“十二五”规划,中科院山西煤化所有关煤液化技术的高效