题目内容
4.从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如图: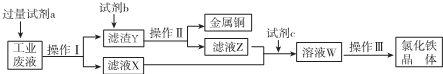
则下列说法正确的是( )
| A. | 试剂a是铁、试剂b是稀硫酸 | |
| B. | 操作I、操作Ⅱ、操作Ⅲ所用仪器相同 | |
| C. | 试剂c可以是H2O2溶液或氯气 | |
| D. | 用酸性KMnO4溶液可检验溶液W中是否还有Fe2+ |
分析 从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜,工业废水中加入试剂a为过量的铁,操作Ⅰ为过滤,得到滤渣Y为Fe、Cu,滤液氯化亚铁溶液,滤渣Y中加入试剂b为盐酸溶解过量的铁生成氯化亚铁溶液,铜不溶,操作Ⅱ过滤得到铜和滤液Z为氯化亚铁溶液,滤液Z和X合并通入氯气,氧化亚铁离子为氯化铁溶液,蒸发结晶,过滤洗涤干燥得到氯化铁晶体,以此解答该题.
解答 解:从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜,工业废水中加入试剂a为过量的铁,操作Ⅰ为过滤,得到滤渣Y为Fe、Cu,滤液氯化亚铁溶液,滤渣Y中加入试剂b为盐酸溶解过量的铁生成氯化亚铁溶液,铜不溶,操作Ⅱ过滤得到铜和滤液Z为氯化亚铁溶液,滤液Z和X合并通入氯气,氧化亚铁离子为氯化铁溶液,蒸发结晶,过滤洗涤干燥得到氯化铁晶体,
A.由最终得到FeCl3及其流程图可知,b为盐酸,若为硫酸会引入硫酸根杂质离子,故A错误;
B.上述分析可知,操作Ⅰ、Ⅱ是过滤,操作Ⅲ是蒸发结晶,过滤,所用仪器不同,故B错误;
C.滤液X,滤液Z中均含有FeCl2,c为氯气或过氧化氢,可氧化氯化亚铁生成氯化铁,故C正确;
D.亚铁离子、氯离子都可以被高锰酸钾溶液氧化,用酸性KMnO4溶液不能检验溶液W中是否还有Fe2+,故D错误;
故选C.
点评 本题考查了常见物质的分离与提纯方法综合应用,为高考常见题型和高频考点,试题有利于培养学生的分析、理解能力及逻辑推理能力,难度不大.

练习册系列答案
相关题目
2.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 在50g质量分数为46%的乙醇水溶液中,含有氢原子数为3NA | |
| B. | 15.6g Na2S和Na2O2固体混合物中,含有的阴离子数为0.2NA | |
| C. | 1L 1mol/L的盐酸中含有HCl分子数为NA | |
| D. | 标准状况下,22.4 L甲醇中含有的C-H的数目为3NA |
19.日常生活中有一种消毒液被广泛使用,该消毒液无色,pH大于7,对某些有色物质有漂白作用.从下列选项中选出你认为它可能的有效成分是( )
| A. | NaClO | B. | Na2CO3 | C. | KMnO4 | D. | H2O2 |
16.0.2mol单质A2和0.3mol单质B2恰好完全反应,生成0.2mol气体C,则C的化学式为( )
| A. | A3B | B. | A3B2 | C. | AB3 | D. | A2B3 |
13.X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时0.01mol/LX和W形成 化合物的水溶液pH为2.下列说法不正确的是( )
| A. | Y、Z、W三种元素组成化合物的水溶液不一定显碱性 | |
| B. | 在Z、Y形成的两种离子化合物中阴阳离子的个数比分别均为1:2 | |
| C. | 原子半径由大到小排列的顺序是:Z>R>W>Y>X | |
| D. | 由于X、Y组成化合物分之间可以形成氢键,使X、Y组成化合物的稳定性高于X、R组成的化合物 |
14.以下说法正确的是( )
| A. | 石英玻璃是以纯碱、石灰石和二氧化硅为原料制成的 | |
| B. | 氮的固定是指将空气中游离的氮转变为氮的化合物的方法 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 纳米材料是指一种称为“纳米”的新物质制成的材料 |
 发展煤的液化技术被纳入“十二五”规划,中科院山西煤化所有关煤液化技术的高效
发展煤的液化技术被纳入“十二五”规划,中科院山西煤化所有关煤液化技术的高效