题目内容
将FeCl3溶液与NH4SCN溶液混合发生如下反应:
①Fe3++SCN-?Fe(SCN)2+(红色)K1=200
②Fe(SCN)2++SCN-?Fe(SCN)2+(深红色)K2
(1)已知:若起始c(Fe3+)、c(SCN-)均为0.001mol/L,测得混合溶液中c(Fe3+)约为8.5×10-4mol/L,c[Fe(SCN)2+]约为1.5×10-4mol/L,c[Fe(SCN)2+]约为5×10-6mol/L,则反应②的平衡常数K2为 .
(2)取两份混合溶液,分别向溶液中滴加同体积同浓度的FeCl3溶液与NH4SCN溶液,溶液颜色均加深,其原因是 .仔细观察,滴加NH4SCN溶液时,混合液颜色更深一些,其原因是 .
(3)向FeCl2与NH4SCN混合溶液中滴加酸化的H2O2溶液,溶液先变红,写出H2O2与Fe2+反应的离子方程式 ,继续滴加H2O2,溶液褪色,产生大量能够使澄清石灰水变浑浊的气体,向反应后的溶液中滴加BaCl2溶液,有白色沉淀生成,简述溶液褪色的原因: .
(4)为测定某溶液中c(Cl-),取待测液V1mL,向其中加入V2mL浓度为c2mol/L的AgNO3溶液(过量),再加入少量铁铵矾[NH4Fe(SO4)2?12H2O]作指示剂,用NH4SCN标准溶液(浓度为c3 mol/L)滴定剩余的Ag+,消耗NH4SCN溶液体积为V3mL.(已知Ag++SCN-=AgSCN↓(白色沉淀),Ksp(AgSCN)=4.9×10-13、Ksp(AgCl)=1.56×10-10).请回答:
①在用NH4SCN标准溶液滴定前,应先通过过滤除去生成的AgCl,若不过滤,则测定结果将 .(填“偏高”,“偏低”或不变).
②最终测得c(Cl-)= mol/L.
①Fe3++SCN-?Fe(SCN)2+(红色)K1=200
②Fe(SCN)2++SCN-?Fe(SCN)2+(深红色)K2
(1)已知:若起始c(Fe3+)、c(SCN-)均为0.001mol/L,测得混合溶液中c(Fe3+)约为8.5×10-4mol/L,c[Fe(SCN)2+]约为1.5×10-4mol/L,c[Fe(SCN)2+]约为5×10-6mol/L,则反应②的平衡常数K2为
(2)取两份混合溶液,分别向溶液中滴加同体积同浓度的FeCl3溶液与NH4SCN溶液,溶液颜色均加深,其原因是
(3)向FeCl2与NH4SCN混合溶液中滴加酸化的H2O2溶液,溶液先变红,写出H2O2与Fe2+反应的离子方程式
(4)为测定某溶液中c(Cl-),取待测液V1mL,向其中加入V2mL浓度为c2mol/L的AgNO3溶液(过量),再加入少量铁铵矾[NH4Fe(SO4)2?12H2O]作指示剂,用NH4SCN标准溶液(浓度为c3 mol/L)滴定剩余的Ag+,消耗NH4SCN溶液体积为V3mL.(已知Ag++SCN-=AgSCN↓(白色沉淀),Ksp(AgSCN)=4.9×10-13、Ksp(AgCl)=1.56×10-10).请回答:
①在用NH4SCN标准溶液滴定前,应先通过过滤除去生成的AgCl,若不过滤,则测定结果将
②最终测得c(Cl-)=
考点:化学平衡常数的含义,化学平衡的影响因素,难溶电解质的溶解平衡及沉淀转化的本质,二价Fe离子和三价Fe离子的检验
专题:化学平衡专题
分析:(1)平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;根据K1=200计算出平衡时SCN-的浓度,再利用K2表达式求出K2;
(2)颜色加深化学平衡向右移动;加入两种物质,均对反应①影响较大,但是加入NH4SCN对反应②也造成了影响;
(3)由于Fe2+具有还原性,可被具有氧化性的H2O2氧化为Fe3+,而H2O2被还原为H2O,结合质量守恒和电荷守恒,写出离子方程式;继续滴加H2O2,产生大量能够使澄清石灰水变浑浊的气体,判断该气体为CO2;向反应后的溶液中滴加BaCl2溶液,有不溶于稀盐酸白色沉淀生成,该沉淀为BaSO4,反应中有SO42-生成,结合生成的N2,写出离子方程式;
(4)①由于Ksp(AgSCN)<Ksp(Ag Cl),有部分AgCl沉淀会与加入的NH4SCN标准溶液转化为AgSCN,消耗的NH4SCN标准溶液偏高,则计算结果中剩余的AgNO3溶液偏高,则与Cl-的AgNO3溶液物质的量偏低,则Cl-物质的量偏低,可判断Cl-测定结果偏低;
②利用加入的AgNO3的物质的量和NH4SCN的物质的量,进行计算,得到答案.
(2)颜色加深化学平衡向右移动;加入两种物质,均对反应①影响较大,但是加入NH4SCN对反应②也造成了影响;
(3)由于Fe2+具有还原性,可被具有氧化性的H2O2氧化为Fe3+,而H2O2被还原为H2O,结合质量守恒和电荷守恒,写出离子方程式;继续滴加H2O2,产生大量能够使澄清石灰水变浑浊的气体,判断该气体为CO2;向反应后的溶液中滴加BaCl2溶液,有不溶于稀盐酸白色沉淀生成,该沉淀为BaSO4,反应中有SO42-生成,结合生成的N2,写出离子方程式;
(4)①由于Ksp(AgSCN)<Ksp(Ag Cl),有部分AgCl沉淀会与加入的NH4SCN标准溶液转化为AgSCN,消耗的NH4SCN标准溶液偏高,则计算结果中剩余的AgNO3溶液偏高,则与Cl-的AgNO3溶液物质的量偏低,则Cl-物质的量偏低,可判断Cl-测定结果偏低;
②利用加入的AgNO3的物质的量和NH4SCN的物质的量,进行计算,得到答案.
解答:
解:(1)平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,K1=
=
=200,[SCN-]=8.8×10-4mol/L,所以K2=
=
=39.7,故答案为:39.7;
(2)加入两种物质,均增大了反应①中反应物浓度,导致化学平衡向右移动,颜色加深;加入NH4SCN增大了反应②中反应物浓度,增大了Fe(SCN)2+的浓度,所以颜色更深,故答案为:两种物质均促使①②反应向正向移动、Fe3+对反应①影响程度较大,NH4SCN不仅促进反应①正向移动,也直接促进反应②正向移动,生成了更多的深红色物质;
(3)由于Fe2+具有还原性,可被具有氧化性的H2O2氧化为Fe3+,而H2O2被还原为H2O,根据反应物和生成物,写出离子方程式:H2O2+2H++2Fe2+=2Fe3++2H2O;继续滴加H2O2,产生大量能够使澄清石灰水变浑浊的气体,判断该气体为CO2;向反应后的溶液中滴加BaCl2溶液,有不溶于稀盐酸白色沉淀生成,该沉淀为BaSO4,反应中有SO42-生成,结合生成的N2,反应的离子方程式:2SCN-+11H2O2=2SO42-+2CO2↑+N2↑+10H2O+2H+,溶液褪色的原因SCN-被H2O2氧化;
故答案为:H2O2+2H++2Fe2+=2Fe3++2H2O;SCN-被H2O2氧化;
(4)①由于Ksp(AgSCN)<Ksp(Ag Cl),有部分AgCl沉淀会与加入的NH4SCN标准溶液转化为AgSCN,消耗的NH4SCN标准溶液偏高,则计算结果中剩余的AgNO3溶液偏高,则与Cl-的AgNO3溶液物质的量偏低,则Cl-物质的量偏低,因此判断测定结果偏低;
故答案为:偏低;
②n(Cl-)=n(AgNO3)(总)-n(AgNO3)(余)=V2 c2-V3 c3,所以c(Cl-)=
;
故答案为:
.
| c[Fe(SCN)2+] |
| c(Fe3+)×c(SCN-) |
| 1.5×10-4 |
| 8.5×10-4c(SCN-) |
| c[Fe(SCN)2+] |
| c[Fe(SCN)2+]×c(SCN-) |
| 5×10-6 |
| 1.5×10-4×8.8×10-4 |
(2)加入两种物质,均增大了反应①中反应物浓度,导致化学平衡向右移动,颜色加深;加入NH4SCN增大了反应②中反应物浓度,增大了Fe(SCN)2+的浓度,所以颜色更深,故答案为:两种物质均促使①②反应向正向移动、Fe3+对反应①影响程度较大,NH4SCN不仅促进反应①正向移动,也直接促进反应②正向移动,生成了更多的深红色物质;
(3)由于Fe2+具有还原性,可被具有氧化性的H2O2氧化为Fe3+,而H2O2被还原为H2O,根据反应物和生成物,写出离子方程式:H2O2+2H++2Fe2+=2Fe3++2H2O;继续滴加H2O2,产生大量能够使澄清石灰水变浑浊的气体,判断该气体为CO2;向反应后的溶液中滴加BaCl2溶液,有不溶于稀盐酸白色沉淀生成,该沉淀为BaSO4,反应中有SO42-生成,结合生成的N2,反应的离子方程式:2SCN-+11H2O2=2SO42-+2CO2↑+N2↑+10H2O+2H+,溶液褪色的原因SCN-被H2O2氧化;
故答案为:H2O2+2H++2Fe2+=2Fe3++2H2O;SCN-被H2O2氧化;
(4)①由于Ksp(AgSCN)<Ksp(Ag Cl),有部分AgCl沉淀会与加入的NH4SCN标准溶液转化为AgSCN,消耗的NH4SCN标准溶液偏高,则计算结果中剩余的AgNO3溶液偏高,则与Cl-的AgNO3溶液物质的量偏低,则Cl-物质的量偏低,因此判断测定结果偏低;
故答案为:偏低;
②n(Cl-)=n(AgNO3)(总)-n(AgNO3)(余)=V2 c2-V3 c3,所以c(Cl-)=
| V2c2-V3c3 |
| V1 |
故答案为:
| V2c2-V3c3 |
| V1 |
点评:本题综合性较大,涉及氧化还原化学方程式的书写、化学平衡常数、平衡移动、电解质溶液有关计算等,难度中等.

练习册系列答案
相关题目
比较下列各组微粒半径,正确的是( )
①Cl<Cl-<Br-②F-<Mg2+<Al3+③Na+<Na<K ④S2-<Cl-<Br-.
①Cl<Cl-<Br-②F-<Mg2+<Al3+③Na+<Na<K ④S2-<Cl-<Br-.
| A、①和③ | B、只有② |
| C、只有③ | D、①和④ |
最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4,并用质谱仪探测到了它存在的证据.下列说法正确的是( )
| A、O4是氧元素的一种同位素 |
| B、O4可能含有极性键 |
| C、同温同压下,等体积的O4气体和O2含有相同的分子数 |
| D、O4转化O2为物理变化 |
在2L密闭容器中,保持恒温,加热KClO3和MnO2固体混合物制取O2,5min后,生成O2 32克,则此反应的平均速率可表示为( )
| A、v(O2)=3.2g?L-1?min-1 |
| B、v(O2)=0.1 mol?L-1?min-1 |
| C、v(KCl)=0.1 mol?L-1?min-1 |
| D、v(KClO3)=0.0667 mol?L-1?min-1 |
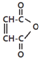 是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径(其中“氧化”指用强氧化剂将醇羟基氧化为羧基).
是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径(其中“氧化”指用强氧化剂将醇羟基氧化为羧基). X、Y、Z、W为短周期的主族元素,其原子序数依次增大.X元素形成的单质是自然界中含量最多的气体.Y是电负性最大的元素.W的原子最外层电子数与核外电子总数之比为3:8.X的原子序数是Z的原子序数的一半.U原子基态的外围电子排布3d104s1.
X、Y、Z、W为短周期的主族元素,其原子序数依次增大.X元素形成的单质是自然界中含量最多的气体.Y是电负性最大的元素.W的原子最外层电子数与核外电子总数之比为3:8.X的原子序数是Z的原子序数的一半.U原子基态的外围电子排布3d104s1.
 我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol?L-1的盐酸溶液.
我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol?L-1的盐酸溶液.