题目内容
在25℃时两种酸的电离常数如下:H2CO3:Ki1=4.2×10-7,Ki2=5.6×10-11;H2S:Ki1=5.7×10-8,Ki2=1.2×10-15,则下列反应可能发生的是( )
| A、NaHCO3+NaHS→Na2CO3+H2S↑ |
| B、H2S+Na2CO3→NaHS+NaHCO3 |
| C、Na2S+H2O+CO2→Na2CO3+H2S↑ |
| D、H2S+NaHCO3→NaHS+H2CO3 |
考点:弱电解质在水溶液中的电离平衡,离子反应发生的条件
专题:离子反应专题,电离平衡与溶液的pH专题
分析:25℃时两种酸的电离常数如下:H2CO3:Ki1=4.2×10-7,Ki2=5.6×10-11;H2S:Ki1=5.7×10-8,Ki2=1.2×10-15,可知碳酸与氢硫酸都是弱酸,电离平衡常数越大,酸性越强,所以酸性H2CO3>H2S>HCO3->HS-,结合强酸制弱酸与物质的性质判断.
解答:
解:25℃时两种酸的电离常数如下:H2CO3:Ki1=4.2×10-7,Ki2=5.6×10-11;H2S:Ki1=5.7×10-8,Ki2=1.2×10-15,可知碳酸与氢硫酸都是弱酸,电离平衡常数越大,酸性越强,所以酸性H2CO3>H2S>HCO3->HS-,
A.H2S>HCO3-,不符合强酸制弱酸原理,故A错误;
B.H2S>HCO3-,所以H2S与Na2CO3反应能生成NaHS和NaHCO3,故B正确;
C.H2S>HCO3-,所以H2CO3与Na2S反应不生成Na2CO3,应该生成NaHCO3,故C错误;
D.H2CO3>H2S,所以不能由H2S和NaHCO3生成H2CO3,故D错误.
故选B.
A.H2S>HCO3-,不符合强酸制弱酸原理,故A错误;
B.H2S>HCO3-,所以H2S与Na2CO3反应能生成NaHS和NaHCO3,故B正确;
C.H2S>HCO3-,所以H2CO3与Na2S反应不生成Na2CO3,应该生成NaHCO3,故C错误;
D.H2CO3>H2S,所以不能由H2S和NaHCO3生成H2CO3,故D错误.
故选B.
点评:本题考查电离平衡常数的运用及酸性强弱的判断,题目难度不大,注意强酸制弱酸原理的应用.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4,并用质谱仪探测到了它存在的证据.下列说法正确的是( )
| A、O4是氧元素的一种同位素 |
| B、O4可能含有极性键 |
| C、同温同压下,等体积的O4气体和O2含有相同的分子数 |
| D、O4转化O2为物理变化 |
将足量NO2通入下列各溶液中,所含离子还能大量共存的是( )
| A、Fe2+、Cl-、SO42-、Na+ |
| B、NH4+、Al3+、NO3-、Cl- |
| C、Ca2+、K+、Cl-、HCO3- |
| D、K+、Na+、SO32-、SO42- |
在2L密闭容器中,保持恒温,加热KClO3和MnO2固体混合物制取O2,5min后,生成O2 32克,则此反应的平均速率可表示为( )
| A、v(O2)=3.2g?L-1?min-1 |
| B、v(O2)=0.1 mol?L-1?min-1 |
| C、v(KCl)=0.1 mol?L-1?min-1 |
| D、v(KClO3)=0.0667 mol?L-1?min-1 |
下列反应属于吸热反应的是( )
| A、氢氧化钠与硝酸反应 |
| B、铁与盐酸反应 |
| C、氢氧化钡与氯化铵反应 |
| D、氧化钙与水反应 |
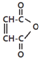 是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径(其中“氧化”指用强氧化剂将醇羟基氧化为羧基).
是一种有机试剂和有机合成原料,是丁烯二酸的酸酐.欲由1,3-丁二烯为原料制取丁烯二酸(HOOCCH=CHCOOH),设计如下四种路径(其中“氧化”指用强氧化剂将醇羟基氧化为羧基). 我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol?L-1的盐酸溶液.
我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol?L-1的盐酸溶液.