��Ŀ����
2������������Ϣ�Իش������������״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״���2H2��g��+CO��g��?CH3OH��g��
��1���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K��
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
��ij�¶��£���2mol CO��6mol H2����2L���ܱ������У���ַ�Ӧ10min�ﵽƽ��ʱ���c��CO��=0.2mol/L�����ʱ���¶�Ϊ250�棻��CH3OH��ʾ�ù��̵ķ�Ӧ���ʣ�v��CH3OH��=0.08mol/��L��min����
��2��ͼ3��ʾ���¶ȷֱ�ΪT1��T2ʱ��ƽ����ϵ��H2�����������ѹǿ�仯���ߣ�A��C����ķ�Ӧ����A�� C�����������=����������ͬ����A��C����Ļ�ѧƽ�ⳣ��A=C����״̬B��״̬A���ɲ������µķ���������¡����¡�����
������ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӣ�Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽���÷�Ӧԭ������������ʵ�飺���ݻ�Ϊ1L���ܱ������У�����1molCO2��3molH2����500���·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����
ʵ����CO2��CH3OH��g�������ʵ�����n����ʱ��仯��ͼ1��ʾ��
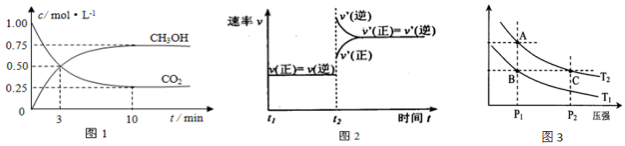
��1���ӷ�Ӧ��ʼ��10min�ﵽƽ�⣬������ƽ����Ӧ����v��H2��=0.225mol/��L•min����500���ƽ��ʱ��CH3OH��g�����������Ϊ30%��
��2��ͼ2�Ǹı��¶�ʱ��ѧ��Ӧ������ʱ��仯��ʾ��ͼ����÷�Ӧ������ӦΪ���ȷ�Ӧ������ȡ������ȡ�����
��3�����д�ʩ�в���ʹCO2��ת�����������BD��
A����ԭ�������ٳ���1mol H2 B����ԭ�������ٳ���1molCO2
C����С�������ݻ� D��ʹ�ø���Ч�Ĵ�����
���� ��1���ٷ���ͼ���¶�����k��С�������淴Ӧ�����ƶ���2H2��g��+CO��g��?CH3OH��g����Ӧ��������ʵ������٣����ݻ�ѧ����ʽ��ƽ�ⳣ��������д������ƽ�ⳣ�����¶ȱ仯�жϷ�Ӧ�����仯��
��ij�¶��£���2molCO��6molH2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c��CO��=0.2mol/L����
CO��g��+2H2��g���TCH3OH��g��
��ʼŨ�ȣ�mol����1 3 0
�仯Ũ�ȣ�mol����0.8 1.6 0.8
ƽ��Ũ�ȣ�mol����0.2 1.4 0.8
����K=$\frac{c��C{H}_{3}OH��}{c��CO��•{c}^{2}��{H}_{2}��}$����ƽ�ⳣ���������ж��¶�
��CH3OH��ʾ�ù��̵ķ�Ӧ���ʣ�v��CH3OH��=$\frac{��c��C{H}_{3}OH��}{��t}$
��2��A��C���㶼�ڵ������ϣ�ѹǿԽ��Ӧ����Խ�죻A��C���㶼�ڵ������ϣ�ƽ�ⳣ��ֻ���¶��йأ��÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ���
��1����ͼ��֪��10min����ƽ�⣬ƽ��ʱ�״���Ũ�ȱ仯Ϊ0.75mol/L���ɷ���ʽ��֪������Ũ�ȱ仯���ڼ״���Ũ�ȱ仯��3��Ϊ2.25mol/L���ݴ˼��㣻�ȸ���Ũ�ȱ仯����ƽ��ʱ�����ʵ�Ũ�ȣ�CH3OH������������ڼ״������ʵ���Ũ���������ʵ���Ũ��֮�ȣ�
��2�����������¶�ƽ�������ȷ�Ӧ�����ƶ��жϣ�
��3��Ҫ���CO2��ת���ʣ�Ӧʹƽ��������Ӧ�����ƶ�������ƽ���ƶ�ԭ�����ѡ���жϣ�
��� �⣺��1���ٷ���ͼ���¶����ߺ�K��С��˵����Ӧ�淽���ƶ������÷�ӦΪ���ȷ�Ӧ����H��0��2H2��g��+CO��g��?CH3OH��g����Ӧ��������ʵ������٣����ԡ�S��0���ʴ�Ϊ����������
��ij�¶��£���2molCO��6molH2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c��CO��=0.2mol/L����
CO��g��+2H2��g���TCH3OH��g��
��ʼŨ�ȣ�mol����1 3 0
�仯Ũ�ȣ�mol����0.8 1.6 0.8
ƽ��Ũ�ȣ�mol����0.2 1.4 0.8
����K=$\frac{c��C{H}_{3}OH��}{c��CO��•{c}^{2}��{H}_{2}��}$=$\frac{0.8}{0.2��1��{4}^{2}}$=2.042�����¶�Ϊ250�棬
v��CH3OH��=$\frac{��c��C{H}_{3}OH��}{��t}$=$\frac{0.8mol/L}{10min}$=0.08mol/��L•min����
�ʴ�Ϊ��250�棻0.08��
��3��A��C���㶼�ڵ������ϣ�ѹǿԽ��Ӧ����Խ�죬��������ΪC��A��
A��C���㶼�ڵ������ϣ�ƽ�ⳣ��ֻ���¶��йأ����Ի�ѧƽ�ⳣ��ΪA=C��
�÷�ӦΪ���ȷ�Ӧ�������¶�ƽ��������Ӧ�����ƶ���NO2�������������������״̬B��״̬A�������ü��ȵķ�����
�ʴ�Ϊ������=�� ���£�
��1����ͼ��֪��10min����ƽ�⣬ƽ��ʱ�״���Ũ�ȱ仯Ϊ0.75mol/L���ɷ���ʽCO2��g��+3H2��g��?CH3OH��g��+H2O��֪��������Ũ�ȱ仯���ڼ״���Ũ�ȱ仯��Ϊ0.75mol/L��3=2.25mol/L����v��H2��=$\frac{2.25mol/L}{10min}$=0.225mol/��L•mon����
��ʼʱc��CO2��=1mol/L��c��H2��=3mol/L��ƽ��ʱc��CO2��=0.25mol/L��c��CH3OH��=c��H2O��=0.75mol/L����c��H2��=3mol/L-0.75mol/L��3=0.75mol/L��CH3OH������������ڼ״������ʵ���Ũ���������ʵ���Ũ��֮�ȣ����Լ״����������=$\frac{0.75mol/L}{��0.25+0.75+0.75+0.75��mol/L}$��100%=30%��
�ʴ�Ϊ��0.225mol/��L•min����30%��
��2������ͼ��֪�������¶ȣ��淴Ӧ���ʴ�������Ӧ���ʣ�ƽ�����淴Ӧ�����ƶ���������Ӧ�Ƿ��ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
��3��A����ԭ�������ٳ���1mol H2��ƽ��������Ӧ�����ƶ���CO2��ת����������ȷ��
B����ԭ�������ٳ���1molCO2CO2��ת���ʷ�����С���ʴ���
C����С�������ݻ�������ѹǿ��ƽ��������Ӧ�����ƶ���CO2��ת����������ȷ��
D��ʹ�ø���Ч�Ĵ�����ƽ�ⲻ�ƶ���CO2��ת���ʲ��䣬�ʴ���
�ʴ�Ϊ��BD��
���� ������Ҫ����ƽ��״̬���жϡ�Ӱ��ƽ���ƶ������ء�ת���ʡ���Ӧ���ʵļ��㡢�缫��Ӧ����д����һ�����ۺ��ԣ��е��Ѷȣ�

��1������һƿA��B�Ļ��Һ����֪���ǵ����������
| ���� | �۵�/�� | �е�/�� | �ܶ�/g•cm-3 | �ܽ��� |
| A | -11.5 | 198 | 1.11 | A��B���ܣ��Ҿ�������ˮ |
| B | 17.9 | 290 | 1.26 |
��2�����������ʣ���ͭ�������ᱵ����NaHCO3���壻��ϡ�������������أ����Ҵ�����Һ̬�Ȼ��⣻����ʯ�������������ᣮ�������ڵ���ʵ��Тڢۢݢߢ⣻д�����ʢ���ˮ��Һ�еĵ��뷽��ʽ��NaHCO3�TNa++HCO3-
��3����֪��Ӧ��2FeCl3+2HI=2FeCl2+2HCl+I2����H2SO3+I2+H2O=2HI+H2SO4��HI��FeCl2��H2SO3 �������ʵĻ�ԭ����ǿ������˳��ΪH2SO3��HI��FeCl2��
��4��һ�������£�XO3n-��I-������Ӧ�����ӷ���ʽΪ��XO3n-+6I-+6H+�TX-+3I2+3H2O�����ƶ�XO3n-��XԪ�صĻ��ϼ�Ϊ+5��n����ֵΪ1��
CH3COOH��aq��+NaOH��aq��=CH3COONa��aq��+H2O ��l����H1=-akJ•mol-1
$\frac{1}{2}$H2SO4��Ũ��+NaOH��aq��=$\frac{1}{2}$Na2SO4��aq��+H2O��l����H2=-b kJ•mol-1
HNO3��aq��+KOH��aq��?KNO3��aq��+H2O��l����H3=-c kJ•mol-1
��a��b��c�Ĺ�ϵ��ȷ���ǣ�������
| A�� | a=b=c | B�� | b��a��c | C�� | b��c��a | D�� | b=c��a |
�ǣ�������
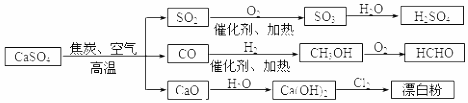
| A�� | CO��SO2��Ϊ��ɫ�д̼�����ζ���ж����� | |
| B�� | ��ҵ������Cl2 �ͳ���ʯ��ˮ��Ӧ����ȡƯ�� | |
| C�� | ��ȥ��ˮ��Ӧ��ͼʾת����Ӧ��Ϊ������ԭ��Ӧ | |
| D�� | ��CO�ϳ�CH3OH�����ϳ�HCHO��������Ӧ��ԭ�������ʾ�Ϊ100% |
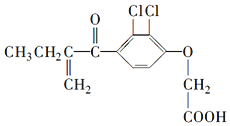
| A�� | ����������������������ķ���ʽ��C14H14Cl2O4 | |
| B�� | ����������ڴ���ͬһƽ���ԭ�Ӳ�����10�� | |
| C�� | 1mol����������7mol H2�����ӳɷ�Ӧ | |
| D�� | ����������FeCl3��Һ������ɫ��Ӧ |
