题目内容
17.强酸和强碱在稀溶液中的中和热可表示为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,下面三个热化学方程式CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O (l)△H1=-akJ•mol-1
$\frac{1}{2}$H2SO4(浓)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H2=-b kJ•mol-1
HNO3(aq)+KOH(aq)?KNO3(aq)+H2O(l)△H3=-c kJ•mol-1
则a、b、c的关系正确的是( )
| A. | a=b=c | B. | b>a>c | C. | b>c>a | D. | b=c>a |
分析 稀的强酸与强碱生成1molH2O放出的热量为中和热,注意弱电解质的电离吸热,浓硫酸溶于水放热,以此解答该题.
解答 解:强酸和强碱在稀溶液中的中和热可表示为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O (l)△H1=-akJ•mol-1,
$\frac{1}{2}$H2SO4(浓)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H2=-b kJ•mol-1,
HNO3(aq)+KOH(aq)?KNO3(aq)+H2O(l)△H3=-c kJ•mol-1,
醋酸的电离吸热,浓硫酸溶于水放热,则放出的热量为b>c>a,
故选C.
点评 本题考查中和热,为高频考点,侧重考查学生的分析能力,明确中和热的概念及弱电解质的电离、浓硫酸溶于水的热效应即可解答,难度不大.

练习册系列答案
相关题目
5.实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
步骤一:配制250mL 0.1000mol/L NaOH标准溶液.
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作4次,记录数据如表.
(1)步骤一需要称量氢氧化钠固体的质量为1.0g,配制标准溶液需要用到玻璃棒,烧杯外,还需要的玻璃仪器有250mL容量瓶,胶头滴管.
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是酸式滴定管.判断滴定终点的现象是最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,且半分钟内不褪色.
(3)根据上述数据,可计算出该盐酸的浓度为0.10mol/L.
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有ADE
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数;
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
步骤一:配制250mL 0.1000mol/L NaOH标准溶液.
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作4次,记录数据如表.
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.02 | 20.00 |
| 2 | 0.10 | 20.00 | 20.00 |
| 3 | 0.10 | 19.98 | 20.00 |
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是酸式滴定管.判断滴定终点的现象是最后一滴NaOH溶液加入时,溶液颜色恰好由无色变为(浅)红色,且半分钟内不褪色.
(3)根据上述数据,可计算出该盐酸的浓度为0.10mol/L.
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有ADE
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数;
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
2.根据下列信息试回答下列问题
(Ⅰ)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的△H<0,△S(熵变)<0,(填“>”、“<”或“=”).
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为250℃;以CH3OH表示该过程的反应速率:v(CH3OH)=0.08mol/(L.min).
(2)图3表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A< C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(Ⅱ)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图1所示:
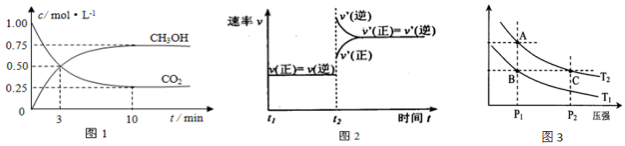
(1)从反应开始到10min达到平衡,氢气的平均反应速率v(H2)=0.225mol/(L•min).500℃达平衡时,CH3OH(g)的体积分数为30%.
(2)图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为放热反应(填“放热”或“吸热”).
(3)下列措施中不能使CO2的转化率增大的是BD.
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂.
(Ⅰ)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为250℃;以CH3OH表示该过程的反应速率:v(CH3OH)=0.08mol/(L.min).
(2)图3表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A< C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(Ⅱ)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图1所示:

(1)从反应开始到10min达到平衡,氢气的平均反应速率v(H2)=0.225mol/(L•min).500℃达平衡时,CH3OH(g)的体积分数为30%.
(2)图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为放热反应(填“放热”或“吸热”).
(3)下列措施中不能使CO2的转化率增大的是BD.
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂.
8.煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol•L-1.反应一段时间后溶液中离子浓度的分析结果如表:
①写出NaClO2溶液脱硝过程中主要反应的离子方程式3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O增加压强,NO的转化率提高(填“提高”“不变”或“降低”).
②随着吸收反应的进行,吸收剂溶液的pH逐渐减小 (填“增大”“不变”或“减小”).
③由实验结果可知,脱硫反应速率大于脱硝反应速率(填“大于”或“小于”).原因是除了SO2和NO在烟气中的初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高.
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反 应中,在反应ClO2-+2SO32-═2SO42-+Cl-的平衡常数K表达式为$\frac{c(C{l}^{-})•{c}^{2}(S{O}_{4}^{2-})}{c(Cl{O}_{2}^{-})•{c}^{2}(S{O}_{3}^{2-})}$.
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果.已知下列反应:
SO2(g)+2OH- (aq)═SO32- (aq)+H2O(l)△H1
ClO- (aq)+SO32- (aq)═SO42- (aq)+Cl- (aq)△H2
CaSO4(s)═Ca2+(aq)+SO42-(aq)△H3
则反应SO2(g)+Ca2+(aq)+ClO- (aq)+2OH- (aq)═CaSO4(s)+H2O(l)+Cl- (aq)的△H=△H1+△H2-△H3.
(1)在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol•L-1.反应一段时间后溶液中离子浓度的分析结果如表:
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
②随着吸收反应的进行,吸收剂溶液的pH逐渐减小 (填“增大”“不变”或“减小”).
③由实验结果可知,脱硫反应速率大于脱硝反应速率(填“大于”或“小于”).原因是除了SO2和NO在烟气中的初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高.
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反 应中,在反应ClO2-+2SO32-═2SO42-+Cl-的平衡常数K表达式为$\frac{c(C{l}^{-})•{c}^{2}(S{O}_{4}^{2-})}{c(Cl{O}_{2}^{-})•{c}^{2}(S{O}_{3}^{2-})}$.
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果.已知下列反应:
SO2(g)+2OH- (aq)═SO32- (aq)+H2O(l)△H1
ClO- (aq)+SO32- (aq)═SO42- (aq)+Cl- (aq)△H2
CaSO4(s)═Ca2+(aq)+SO42-(aq)△H3
则反应SO2(g)+Ca2+(aq)+ClO- (aq)+2OH- (aq)═CaSO4(s)+H2O(l)+Cl- (aq)的△H=△H1+△H2-△H3.
3.取一定质量镁铝合金,溶于足量盐酸,加过量NaOH溶液,滤出沉淀,加强热灼烧,得白色粉末,干燥后称量,这些粉末与原合金质量相等,则原合金中铝的质量分数为( )
| A. | 30% | B. | 40% | C. | 60% | D. | 70% |
4.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 室温下,1L pH=13的氢氧化钡溶液所含OH- 数为0.2NA | |
| B. | 标准状况下,0.1molAl3+含有的核外电子数为0.3 NA | |
| C. | 常温下,44gCO2中含有2NA个碳氧双键 | |
| D. | 将1 molN2 和3mol H2 通入密闭容器中,一定条件下充分反应,转移电子数为6NA |
 4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3 mol,则此反应的平均速率v为( )
4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3 mol,则此反应的平均速率v为( )