题目内容
3.NA为阿伏加德罗常数,下列叙述错误的是( )| A. | 18gH2O中含的质子数为10NA | |
| B. | 1.7克H2O2中含有的电子数为0.9 NA | |
| C. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1 mol Na 与足量O2反应,生成Na2O和Na2O2的混合物,钠失去2NA个电子 |
分析 A.求出18gH2O的物质的量,然后根据水中含10个质子来分析;
B.计算过氧化氢物质的量,依据过氧化氢含有18个电子分析;
C.NO2和N2O4的最简式均为NO2;
D.钠与氧气反应无论生成氧化钠还是过氧化钠,钠都变为钠离子,失去1个电子,据此分析.
解答 解:A.18gH2O的物质的量为1mol,而水中含10个质子,故1mol水中含10NA个质子,故A正确;
B.1.7克H2O2物质的量为$\frac{1.7g}{34g/mol}$=0.05mol,含有的电子数为0.05mol×18×NA=0.9 NA,故B正确;
C.NO2和N2O4的最简式均为NO2,46g NO2和N2O4混合气体中含有NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,故含有3mol原子,即3NA个,故C正确;
D.1 mol Na 与足量O2反应,生成Na2O和Na2O2的混合物,反应生成1mol钠离子,钠失去NA个电子,故D错误;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,题目难度不大.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
13. 反应Ⅰ和反应Ⅱ都是有机合成中的重要反应:下列有关说法正确的是( )
反应Ⅰ和反应Ⅱ都是有机合成中的重要反应:下列有关说法正确的是( )
 反应Ⅰ和反应Ⅱ都是有机合成中的重要反应:下列有关说法正确的是( )
反应Ⅰ和反应Ⅱ都是有机合成中的重要反应:下列有关说法正确的是( )| A. | 苯乙酮的一氯代物有6种同分异构体 | |
| B. | 苯乙酮经反应Ⅰ所得产物的所有原子不可能在同一平面内 | |
| C. | 反应Ⅱ为取代反应 | |
| D. | 反应Ⅱ可以在强碱性条件下进行 |
11.在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g,此混合气体中C和O两种原子的物质的量之比为( )
| A. | 3:4 | B. | 4:3 | C. | 2:1 | D. | 1:2 |
18.下列变化中需加入氧化剂才能实现的是( )
| A. | Na2S→H2S | B. | MnO4-→Mn2+ | C. | I-→I2 | D. | ClO-→Cl2 |
15.下列说法正确的是( )
| A. | BaSO4难溶于水,BaSO4属于非电解质 | |
| B. | 非电解质的水溶液一定不导电 | |
| C. | 电解质主要包括:酸、碱、盐和部分氧化物 | |
| D. | 电解质在任何情况下均一定导电 |
12.实验室用标准 KMnO4 溶液滴定未知浓度的 FeSO4,下列说法或操作正确的是( )
| A. | 盛 FeSO4溶液的锥形瓶滴定前用 FeSO4溶液润洗 2-3 次 | |
| B. | 选碱式滴定管盛放标准 KMnO4溶液,并用碘化钾淀粉溶液作指示剂 | |
| C. | 滴定前仰视读数,滴定后俯视读数会导致滴定结果偏低 | |
| D. | 锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 |
13.联氨可用作火箭燃料,其电子式为 ,则N元素的化合价为( )
,则N元素的化合价为( )
 ,则N元素的化合价为( )
,则N元素的化合价为( )| A. | -3 | B. | -2 | C. | 0 | D. | +5 |
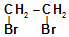 ..
..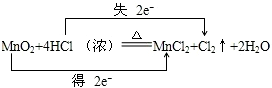 .
.