题目内容
2.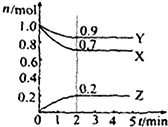 某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,图中数据分析:
某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,图中数据分析:(1)该反应的化学方程式为:0.05mol/•(L•min).
(2)反应开始至2min,用Z表示的平均反应速率为:3X+Y?2Z.
(3)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+Y(g)=2Z(g),当改变下列条件时,反应速率会减小AC
A.降低温度 B.加入催化剂 C.增大容器体积.
分析 (1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)根据v=$\frac{△c}{△t}$计算反应速率v(Z);
(3)根据温度、浓度、催化剂、压强对反应速率的影响来回答.
解答 解:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z;
(2)在2min时间内,用Z表示反应的平均速率v(Z)=$\frac{△c}{△t}$=$\frac{\frac{0.2}{2}}{2}$=0.05mol/(L•min),故答案为:0.05mol/•(L•min);
(3)A.降低温度,反应速率减慢,故A正确;
B.加入催化剂会加快反应速率,故B错误;
C.增大容器体积相当于减小浓度,所以速率减慢,故C正确;
故选AC.
点评 本题考查化学平衡图象分析意义反应速率的影响因素知识,题目难度不大,注意分析各物质的量的变化曲线,把握化学方程式的判断方法.

练习册系列答案
相关题目
12.某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2- 中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如下实验:
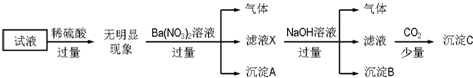
下列说法正确的是( )

下列说法正确的是( )
| A. | 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- | |
| B. | 无法确定原试液中是否含有K+ | |
| C. | 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ | |
| D. | 无法确定沉淀C的成分 |
10. 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )
 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )| A. | S2Cl2与H2O反应的化学方程式可能为: 2S2Cl2+2H2O=SO2↑+3S↓+4HCl | |
| B. | S2Cl2为含有极性键和非极性键的极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 | |
| D. | S2Cl2的电子式是:Cl |
17.下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )
| A. | 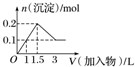 向1L浓度均为0.1 mol•L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol•L-1的稀H2SO4 | |
| B. | 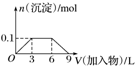 向1L浓度分别为0.1 mol•L-1和0.3 mol•L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol•L-1的稀NaOH溶液 | |
| C. | 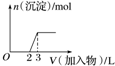 向烧碱溶液中滴加明矾溶液 | |
| D. | 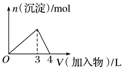 向AlCl3溶液中滴加过量氨水 |
7.下列物质的熔点均按由高到低的次序排列,其原因是由于键能由大到小排列的是( )
| A. | 钠、干冰 | B. | 金刚石、晶体硅 | ||
| C. | 碘化氢、溴化氢 | D. | 二氧化硅、二氧化碳 |
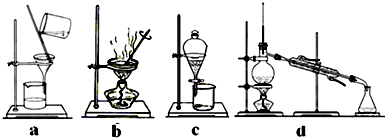
11.电子工业中用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液.由该废液回收铜并得到净水剂(FeCl3•6H2O)的步骤如下:
I.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,不断通入氯气至完全反应;
IV.加热蒸发、浓缩结晶,得到FeCl3•6H2O晶体.
(1)用FeCl3溶液腐蚀铜箔的离子方程式是Cu+2Fe3+=Cu2++2Fe2+,.
(2)试剂A是盐酸.
(3)步骤III反应过程中既有Fe2+又有Fe3+,如果要验证滤液中铁元素的存在形式,可另取反应过程中的两份滤液分别进行实验,实验方法、现象与结论如下表,请将其补充完整.可供选择的试剂:
a.酸性KMnO4 b.NaOH溶液 c.KSCN溶液 d.氯水
(4)完成步骤IV需要用到的实验装置是ab(填字母).
I.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,不断通入氯气至完全反应;
IV.加热蒸发、浓缩结晶,得到FeCl3•6H2O晶体.
(1)用FeCl3溶液腐蚀铜箔的离子方程式是Cu+2Fe3+=Cu2++2Fe2+,.
(2)试剂A是盐酸.
(3)步骤III反应过程中既有Fe2+又有Fe3+,如果要验证滤液中铁元素的存在形式,可另取反应过程中的两份滤液分别进行实验,实验方法、现象与结论如下表,请将其补充完整.可供选择的试剂:
a.酸性KMnO4 b.NaOH溶液 c.KSCN溶液 d.氯水
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液中加入c(填字母) | 液变成血红色 | 滤液中有Fe3+ |
| 步骤2:在滤液中加入a(填字母) | 紫红色褪去 | 滤液中有Fe2+ |
