题目内容
12.下列说法不正确的是( )①将BaSO4放入水中不能导电,所以BaSO4是非电解质
②氨溶于水得到的氨水能导电,所以氨水是电解质
③H2SO4固态不导电,液态可以导电
④A12O3固态不导电,熔融态也不导电.
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
分析 ①硫酸钡是难溶的盐,熔融状态完全电离;
②氨气本身不能电离出离子,溶液导电是氨气和水反应生成的一水合氨弱电解质电离的原因;
③熔融态共价化合物不能电离出离子,不能导电;
④离子化合物熔融态电离出离子,能导电;
⑤溶液导电能力取决于溶液中离子浓度的大小,与电解质强弱无关.
解答 解:①硫酸钡是难溶的盐,熔融状态完全电离;所以BaSO4是强电解质,故①错误;
②氨气本身不能电离出离子,溶液导电是氨气和水反应生成的一水合氨弱电解质电离的原因,氨气不是电解质,故②错误;
③熔融态共价化合物不能电离出离子,不能导电;所以液态硫酸也不能导电,故③错误;
④离子化合物熔融态电离出离子,能导电,氧化铝是离子化合物,熔融状态能导电,故④错误;故选D.
点评 本题考查了强电解质、弱电解质和非电解质的判断,难度不大,明确电解质的强弱与电离程度有关,与溶液的导电能力大小无关.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
3.在下列条件下,一定能大量共存的微粒组是( )
| A. | 甲基橙呈黄色的溶液中:K+、Na+、SO42-、S2O32- | |
| B. | 能与Al反应生成H2的溶液:Na+、Ba2+、NO3-、I- | |
| C. | 常温下水电离出的OH-为1×10-7mol/L的溶液中:K+、Na+、SO42-、AlO2- | |
| D. | 常温下pH=7的溶液中:NH4+、K+、CH3COO-、NO3- |
20.下列离子在溶液中能大量共存的是( )
| A. | Cl-、NO3-、Fe3+、Na+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Cu2+、NH4+、Br-、OH- |
7.下列与实验相关的叙述正确的是( )
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 用浓硫酸配制一定物质的量浓度的硫酸溶液时,溶解后的溶液未冷却至室温就转移入容量瓶,会造成所配溶液浓度偏高 | |
| C. | 溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水,变浑浊,原溶液一定含有CO32- | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
17.下列叙述不正确的是( )
| A. | 溶质质量分数分别为a%和5a%的硫酸溶液按等体积混合,混合溶液中硫酸的质量分数大于3a% | |
| B. | 将1体积cmol/L硫酸溶液用水稀释为5体积,得到0.2cmol/L硫酸溶液 | |
| C. | 10mL质量分数14%的氨水,用水稀释至100mL,氨水的质量分数小于1.4% | |
| D. | 将w g a% NaCl溶液蒸发掉$\frac{w}{2}$ g水,得到4a% NaCl溶液 |
4.成语是中华民族灿烂文化中的瑰宝,下列涉及氧化还原反应的是( )
| A. | 蜡炬成灰 | B. | 木已成舟 | C. | 铁柱成针 | D. | 滴水成冰 |
1.氢氧化铝在水中可建立如下平衡:Al3++3OH-?Al(OH)3?H++AlO2-+H2O,运用勒夏特列原理判断,下列叙述中正确的是( )
| A. | 向以上平衡体系中加入足量浓NaOH溶液,两平衡都向右移动,Al(OH)3的质量增加 | |
| B. | 向以上平衡体系中加入足量浓盐酸,Al3+的物质的量增加 | |
| C. | 在同一溶液中,Al3+与OH-能大量共存 | |
| D. | 在同一溶液中,AlO2-与H+能大量共存 |
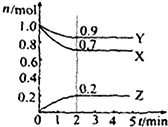 某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,图中数据分析:
某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,图中数据分析: