题目内容
15.有关元素砷(33As)的下列叙述中正确的是( )| A. | 砷元素的最高化合价为+3 | B. | 砷元素是第四周期的主族元素 | ||
| C. | 砷原子的次外层上有8个电子 | D. | 砷的氧化物的水化物是强酸 |
分析 砷的原子结构示意图为: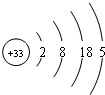 ,砷位于第四周期第ⅤA族,砷和氮元素处于同一主族,根据同一主族元素的性质具有相似性和递变性分析.
,砷位于第四周期第ⅤA族,砷和氮元素处于同一主族,根据同一主族元素的性质具有相似性和递变性分析.
解答 解:A.主族元素的最高化合价与其族序数相同(但O、F除外),所以砷的最高化合价是+5价,故A错误;
B.根据原子结构示意图知,原子核外有4个电子层,则砷位于第四周期,故B正确;
C.根据原子示意图知,砷的第三电子层上有18个电子,故C错误;
D.砷和磷元素处于同一主族,同一主族元素的性质具有相似性,所以砷的氧化物的水溶液呈酸性,已知同主族从上到下最高价氧化物的水化物的酸性减弱,则砷酸的酸性小于磷酸,所以不是强酸,故D错误;
故选:B.
点评 本题考查元素的原子序数及位置,明确元素在周期表中的位置及元素周期律即可解答,题目难度不大.

练习册系列答案
相关题目
6.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=7的溶液中:K+、Na+、Fe3+、SO42- | |
| B. | 饱和NaHCO3溶液中:Al3+、NO3-、I-、Cl- | |
| C. | 水电离产生的c(H+)=10-13 mol•L-1的溶液中:Na+、I-、NO3-、HCO3- | |
| D. | 0.1 mol•L-1FeSO4溶液中:K+、Zn2+、Br-、I- |
3.根据原子结构或元素周期律的知识,下列说法正确的是( )
| A. | 35Cl和37Cl中子数不同,所以它们的原子结构示意图、电子式、核外电子排布式、轨道表达式都不相同 | |
| B. | 两个不同原子的1s、2s、2p、3s、3P各亚层中电子的能量相同 | |
| C. | 短周期主族元素原子最外层电子数一定等于其最高化合价 | |
| D. | CO2通入Na2SiO3溶液中可以得到硅酸 |
7.日常生活中使用的购物袋的材料多为聚乙烯,下列有关说法中正确的是( )
| A. | 用纯净的乙烯合成的聚乙烯是纯净物 | |
| B. | 聚乙烯可以人工合成,也可以是天然高分子化合物 | |
| C. | 聚乙烯高温分解,生成其单体--乙烯 | |
| D. | 聚乙烯的单体能够使溴的四氯化碳溶液褪色 |
7. 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )| A. | 电子由O2所在的铂电极流出 | |
| B. | 该电池的负极反应式为:CH3CH2OH+H2O-4e-═CH3COOH+4H+ | |
| C. | O2所在的铂电极处发生还原反应 | |
| D. | 微处理器通过检测电流大小计算出被测气体中酒精的含量 |
8.在等物质的量浓度的Na2CO3和NaHCO3的混合溶液中,下列说法正确的是( )
| A. | c(HCO3-)略大于c(CO32-) | B. | c(HCO3-)等于c(CO32-) | ||
| C. | c(Na+)等于c(CO32-)与c(HCO3-)之和 | D. | c(HCO3-)略小于c(CO32-) |
 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为: 向10L的密闭容器中0.40mol A气体和0.20mol B气体,在一定条件下使其发生反应生成气体C,其物质的量的变化如图:
向10L的密闭容器中0.40mol A气体和0.20mol B气体,在一定条件下使其发生反应生成气体C,其物质的量的变化如图: