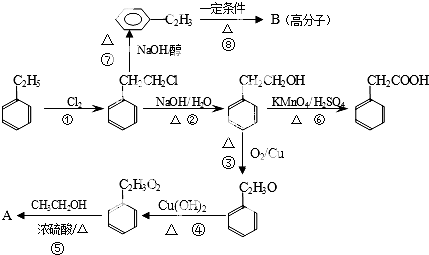
题目内容
7. 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )| A. | 电子由O2所在的铂电极流出 | |
| B. | 该电池的负极反应式为:CH3CH2OH+H2O-4e-═CH3COOH+4H+ | |
| C. | O2所在的铂电极处发生还原反应 | |
| D. | 微处理器通过检测电流大小计算出被测气体中酒精的含量 |
分析 该装置中含有质子交换膜,则电解质溶液为酸性,酸性条件下,乙醇燃料电池中,负极上乙醇失电子发生氧化反应,正极上是氧气得电子的还原反应;根据图示得出酸性燃料电池的反应物和生成物,再根据原电池原理写出该电池的反应式来判断.
解答 解:A、乙醇燃料电池中,负极上乙醇失电子发生氧化反应,正极上是氧气得电子的还原反应,电子由O2所在的铂电极流入,从乙醇电极流出,故A错误;
B、该电池的负极上乙醇失电子发生氧化反应,由装置图可知酒精在负极被氧气氧化发生氧化反应生成醋酸,CH3CH2OH-4e-+H2O=4H++CH3COOH,故B正确;
C、乙醇燃料电池中,正极上是氧气得电子的还原反应,O2所在的铂电极处发生还原反应,故C正确;
D、根据微处理器通过检测电流大小可以得出电子转移的物质的量,根据电极反应式可以计算出被测气体中酒精的含量,故D正确.
故选A.
点评 本题以乙醇为燃料考查了燃料电池,难度不大,注意正负极上电极反应式的书写要结合电解质溶液的酸碱性,即使燃料和氧化剂相同,如果电解质溶液不同,电极反应式也不同.

练习册系列答案
相关题目
14.短周期主族元素X、Y、Z、W、M的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,z的单质能溶于w的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法不正确的是( )
| A. | 元素W的气态氢化物与M的单质可发生置换反应 | |
| B. | 离子半径的大小顺序为W>M>Z>X>Y | |
| C. | 元素Z、M的单质在一定条件下均能和强碱溶液反应 | |
| D. | 元素X与Y可以形成5种以上的化合物 |
15.有关元素砷(33As)的下列叙述中正确的是( )
| A. | 砷元素的最高化合价为+3 | B. | 砷元素是第四周期的主族元素 | ||
| C. | 砷原子的次外层上有8个电子 | D. | 砷的氧化物的水化物是强酸 |
2.根据下列反应判断有关物质还原性由强到弱的顺序是( )
H2SO3+I2+H2O═2HI+H2SO4;2FeCl3+2HI═2FeCl2+2HCl+I2.
H2SO3+I2+H2O═2HI+H2SO4;2FeCl3+2HI═2FeCl2+2HCl+I2.
| A. | FeCl2>HI>H2SO3 | B. | HI>FeCl2>H2SO3 | C. | H2SO3>HI>FeCl2 | D. | FeCl2>H2SO3>HI |
12.下列对有机物的性质描述正确的是( )
| A. | 含有羟基的有机物都能与醋酸发生酯化反应 | |
| B. | 氨基酸、乙酸和苯酚都能与氢氧化钠溶液反应 | |
| C. | 醇类、卤代烃都能发生消去反应 | |
| D. | 除饱和烃之外的其他烃都能发生聚合反应 |
16.25℃时,下列有关0.10mol/L Na2SO3溶液的叙述正确的是(忽略溶液体积变化及被空气氧化)( )
| A. | 与漂白粉溶液反应的离子方程式:Ca2++SO32-═CaSO3↓ | |
| B. | 通入SO2至过量:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| C. | 通入HCl至溶液pH=7:c(HSO3-)<c(Cl-) | |
| D. | 加入NaOH固体可使溶液中水的电离程度增大 |
17.下列关于Li、Na、K、Rb、Cs的叙述中不正确的是( )
| A. | 金属性最强的是铯 | |
| B. | 密度随核电荷数的增加而增大 | |
| C. | 单质的熔、沸点随核电荷数的增加而降低 | |
| D. | 最高价氧化物的水化物的碱性随核电荷数的增加而增强 |