题目内容
8. 图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的( )
图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的( )| a极板 | b极析 | X电极 | Z溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 负极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
| A. | A | B. | B | C. | D |
分析 先根据题意判断a、b、x、y电极名称,发现a极板质量增加,则a极析出金属,a极为阴极,b极板处有无色无臭气体放出,b极为阳极,所以x为负极,y为正极,根据溶液中得失电子判断电解质溶液的成分及电极材料,分析判断.
解答 解:通电后发现a极板质量增加,所以金属阳离子在a极上得电子,a极是阴极;b极是阳极,b极板处有无色无臭气体放出,即溶液中氢氧根离子放电生成氧气,电极材料必须是不活泼的非金属,所以X为负极,Y为正极,
A、Zn作阴极,石墨为阳极,阴极上铜离子得电子生成Cu,阳极上氢氧根离子失电子生成氧气,故A正确;
B、电解氢氧化钠溶液在两极上分别得到氧气和氢气,得不到金属单质,故B错误;
C、铁是活泼金属,作阳极失电子,所以在b极上得不到气体,故C正错误;
D、电解质溶液中氯离子失电子,在b极上得到有刺激性气味的气体,与题意不符,故D错误.
故选A.
点评 本题考查了电解池工作原理,明确溶液中离子的放电顺序是解本题的关键,解题时还要注意正极的电极材料,如果是较活泼的金属,电极材料失电子,不是溶液中离子失电子,题目难度不大.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
16.下列给定条件的有机化合物的同分异构体数目正确的是
| 选项 | 给定条件的有机化合物 | 同分异构体数目 |
| A | 分子式为C4H9Cl的有机物 | 3种 |
| B | 分子式为C5H10O2的一元酯 | 8种 |
| C | 分子式为C5H10的环烷烃 | 3种 |
| D |  的一溴代物 的一溴代物 | 5种 |
| A. | A | B. | B | C. | C | D. | D |
17.工业上食用油的生产大多数采用浸出工艺.菜籽油的生产过程为将菜籽压成薄片,用轻汽油浸泡,进行操作A:过滤,得液体混合物;对该混合物迸行操作B,制成半成品油,再经过脱胶、脱色、脱臭即制成食用油.操作A和B的名称分别是( )
| A. | 溶解、蒸发 | B. | 萃取、蒸馏 | C. | 分液、蒸馏 | D. | 萃取、过滤 |
16.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答:
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=1.5×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
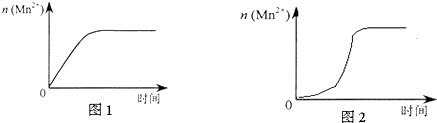
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min).
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 2.0 | 3.0 | 3.0 | 2.0 | 5.2 |
| 3 | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=1.5×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.

①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
3.下列实验现象与反应方程式或离子方程式,正确的是( )
| A. | 切开的金属Na暴露在空气中,光亮的表面逐渐变暗2Na+O2═Na2O2 | |
| B. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀 SO42-+Ba2+═BaSO4↓ | |
| C. | Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+CO2═2Na2CO3+O2 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀HCO3-+Ca2++OH-═CaCO3↓+H2O |
17.如图是MgSO4、NaCl的溶解度曲线.下列说法一定正确的是( )


| A. | 把t2℃时的MgSO4饱和溶液的温度升高,溶液仍然饱和 | |
| B. | 将t3℃时的MgSO4饱和溶液的温度降低,有晶体析出 | |
| C. | t2℃时,饱和溶液的溶质物质的量浓度:MgSO4比NaCl大 | |
| D. | 分别将t1℃时MgSO4饱和溶液、NaCl饱和溶液的温度升高到t2℃,所得溶液的溶质质量分数前者更大 |
18.请回答:
I.(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝.写出该反应的离子反应方程式:2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑.
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.
(3)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3).现取适量这种钴的氧化物,可与480mL 5mol•L-1盐酸恰好完全反应,得到CoCl2溶液和6.72L黄绿色气体(标准状况).则该反应的化学反应方程式为Co3O4+8HCl═3CoCl2+Cl2↑+4H2O.
Ⅱ.下表给出五种元素的相关信息,其中A、B、C、D为短周期元素.根据以下信息填空:
(4)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1:2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式:2N2H4+N2O4═3N2+4H2O.
(5)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为H2SO4═2H++SO42-;常温下,E的单质与化合物X稀溶液反应生成盐Y,Y的化学式是FeSO4.化合物Z仅由元素D和E组成,Z+H2O+O2→X+Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式:2FeS2+2H2O+7O2═2FeSO4+2H2SO4.
(6)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成将气体产物通入品红溶液,如果品红溶液褪色,则含有SO2,反之则无SO2.取适量吸收液于试管,滴加适量盐酸酸化,再滴加BaCl2,如有白色沉淀生成,则含有SO3,反之则无SO3.
I.(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝.写出该反应的离子反应方程式:2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑.
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.
(3)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3).现取适量这种钴的氧化物,可与480mL 5mol•L-1盐酸恰好完全反应,得到CoCl2溶液和6.72L黄绿色气体(标准状况).则该反应的化学反应方程式为Co3O4+8HCl═3CoCl2+Cl2↑+4H2O.
Ⅱ.下表给出五种元素的相关信息,其中A、B、C、D为短周期元素.根据以下信息填空:
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 它在地壳中储量丰富,是人体不可缺少的微量元素之一.其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(5)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为H2SO4═2H++SO42-;常温下,E的单质与化合物X稀溶液反应生成盐Y,Y的化学式是FeSO4.化合物Z仅由元素D和E组成,Z+H2O+O2→X+Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式:2FeS2+2H2O+7O2═2FeSO4+2H2SO4.
(6)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成将气体产物通入品红溶液,如果品红溶液褪色,则含有SO2,反之则无SO2.取适量吸收液于试管,滴加适量盐酸酸化,再滴加BaCl2,如有白色沉淀生成,则含有SO3,反之则无SO3.
 .
.