题目内容
17.工业上食用油的生产大多数采用浸出工艺.菜籽油的生产过程为将菜籽压成薄片,用轻汽油浸泡,进行操作A:过滤,得液体混合物;对该混合物迸行操作B,制成半成品油,再经过脱胶、脱色、脱臭即制成食用油.操作A和B的名称分别是( )| A. | 溶解、蒸发 | B. | 萃取、蒸馏 | C. | 分液、蒸馏 | D. | 萃取、过滤 |
分析 根据物质在不同溶剂中溶解度的不同采用萃取方法分离提纯物质,互溶的液体采用蒸馏方法分离提纯,据此分析解答.
解答 解:根据相似相溶原理知,食用油易溶于轻汽油,该方法为萃取;食用油和轻汽油互溶且二者沸点相差较大,所以可以采用蒸馏方法分离,故选B.
点评 本题考查物质分离和提纯,为高频考点,明确蒸馏、萃取、过滤等实验原理是解本题关键,利用物质性质差异性选取合适的分离提纯方法,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列表述中正确的是( )
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ | |
| B. | 由C(石墨,s)═C(金刚石,s)△H=+11.9 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H不同 | |
| D. | 任何一个化学变化都伴随着能量的变化 |
8.MnO2和锌是制造干电池的主要原料.
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
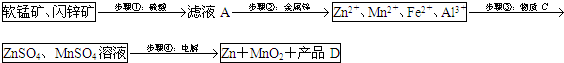
已知各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+
,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+
.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
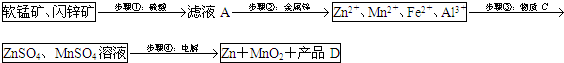
已知各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+
,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+
.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
12.相对分子质量为114的烷烃,分子中含有两个相同支链的同分异构体共有(不考虑立体异构)( )
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
4.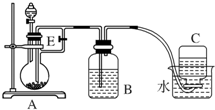 如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验提供的试剂:铁屑、6mol/L硫酸溶液、NaOH溶液.下列说法错误的是( )
如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验提供的试剂:铁屑、6mol/L硫酸溶液、NaOH溶液.下列说法错误的是( )
 如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验提供的试剂:铁屑、6mol/L硫酸溶液、NaOH溶液.下列说法错误的是( )
如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验提供的试剂:铁屑、6mol/L硫酸溶液、NaOH溶液.下列说法错误的是( )| A. | B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑 | |
| B. | 实验开始时应先将活塞E关闭 | |
| C. | 生成Fe(OH)2的操作为:关闭E,使A中溶液压入B瓶中 | |
| D. | 取下装置B中的橡皮塞,使空气进入,有关反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
8.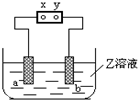 图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的( )
图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的( )
 图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的( )
图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的( )| a极板 | b极析 | X电极 | Z溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 负极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
| A. | A | B. | B | C. | D |
9.葡萄糖酸钙是一种可促进骨骼生长的营养物质.葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
实验流程如下:
C6H12O6溶液 $→_{①}^{滴加3%溴水/55℃}$$→_{②}^{过量CaCO_{3}/70℃}$$→_{③}^{趁热过滤}$$→_{④}^{乙醇}$悬浊液$→_{⑤}^{抽滤}$$→_{⑥}^{洗涤}$$→_{⑦}^{干燥}$Ca(C6H11O7)2
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是:B.
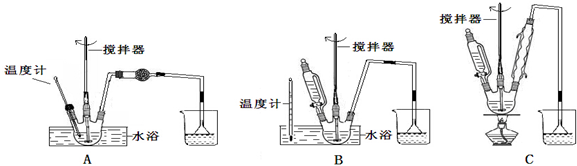
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是C.
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是提高葡萄糖酸的转化率;本实验中不宜用CaCl2替代CaCO3,理由是氯化钙难以与葡萄糖酸直接反应生成葡萄糖酸钙沉淀.
(3)第③步需趁热过滤,其原因是防止葡萄糖酸钙冷却结晶析出.
(4)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙的析出.
(5)第⑥步中,下列洗涤剂最合适的是C.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水、易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
C6H12O6溶液 $→_{①}^{滴加3%溴水/55℃}$$→_{②}^{过量CaCO_{3}/70℃}$$→_{③}^{趁热过滤}$$→_{④}^{乙醇}$悬浊液$→_{⑤}^{抽滤}$$→_{⑥}^{洗涤}$$→_{⑦}^{干燥}$Ca(C6H11O7)2
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是:B.

制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是C.
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是提高葡萄糖酸的转化率;本实验中不宜用CaCl2替代CaCO3,理由是氯化钙难以与葡萄糖酸直接反应生成葡萄糖酸钙沉淀.
(3)第③步需趁热过滤,其原因是防止葡萄糖酸钙冷却结晶析出.
(4)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙的析出.
(5)第⑥步中,下列洗涤剂最合适的是C.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.
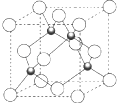 原子序数小于36 的X、Y、Z、W 四种元素,其中X 形成的单质是最轻的物质,Y 原子基态时最外层电子数是其内层电子数的2 倍,Z 原子基态时2p 原子轨道上有3 个未成对的电子,W 的原子序数为29.回答下列问题:
原子序数小于36 的X、Y、Z、W 四种元素,其中X 形成的单质是最轻的物质,Y 原子基态时最外层电子数是其内层电子数的2 倍,Z 原子基态时2p 原子轨道上有3 个未成对的电子,W 的原子序数为29.回答下列问题: 在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2
在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2