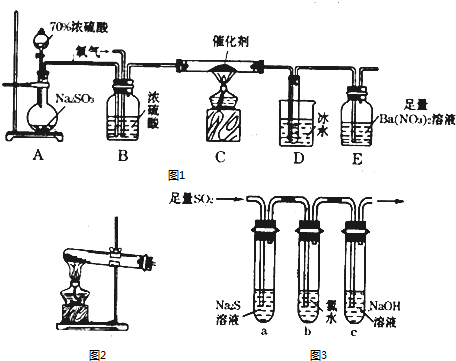
题目内容
20.X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.请回答下列问题:
(1)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式)C2H2.
(2)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A$?_{d}^{c}$B(在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体.写出C的结构式:O=C=O;D的电子式:
 .
.①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为NaAlO2;
由A转化为B的离子方程式为AlO2-+2H2O+CO2=Al(OH)3+HCO3-或2AlO2-+3H2O+CO2=2Al(OH)3+CO32-.
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性.用离子方程式表示A溶液显碱性的原因:CO32-+H2O?HCO3-+OH-.A、B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有NaCl、NaHCO3、CO2(或H2CO3).
分析 X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X、Y两元素最高正价与最低负价之和均为0,且Q与X同主族,则X、Q处于ⅠA族,Y处于ⅣA族,故X为氢元素,Q为Na元素,Y为碳元素;Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z为氧元素、R为Al元素,以此来解答.
解答 解:X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X、Y两元素最高正价与最低负价之和均为0,且Q与X同主族,则X、Q处于ⅠA族,Y处于ⅣA族,故X为氢元素,Q为Na元素,Y为碳元素;Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z为氧元素、R为Al元素,
(1)碳和氢元素形成多种化合物,其中含有极性键和非极性键的相对分子质量最小的物质为乙炔,分子式为C2H2,故答案为:C2H2;
(2)由以上某些元素组成的化合物A、B、C、D有如下转化关系A$?_{d}^{c}$B(在水溶液中进行),其中,C是溶于水显酸性的气体,则C为CO2,D是淡黄色固体,则D为Na2O2,则CO2的结构式为O=C=O,Na2O2的电子式为 ,
,
故答案为:O=C=O; ;
;
①如果A、B均由三种元素组成,B为两性不溶物,结合转化关系可知,A为NaAlO2、B为Al(OH)3,偏铝酸根与二氧化碳、水反应生成氢氧化铝与碳酸根,A转化为B的反应离子方程式为AlO2-+2H2O+CO2=Al(OH)3+HCO3-或2 AlO2-+3 H2O+CO2=2 Al(OH)3+CO32-,
故答案为:NaAlO2;AlO2-+2H2O+CO2=Al(OH)3+HCO3-或2 AlO2-+3 H2O+CO2=2 Al(OH)3+CO32-;
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性,结合转化关系可知,A为Na2CO3、B为NaHCO3,C为二氧化碳符合转化,Na2CO3溶液水解溶液显碱性,水解方程式为:CO32-+H2O?HCO3-+OH-,在碳酸钠和碳酸氢钠的混合溶液中碳酸根离子水解程度大于碳酸氢根离子水解程度,所以溶液中的碳酸氢根离子浓度大于碳酸根离子,溶液显碱性,离子浓度关系为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+):当溶液中滴加盐酸,则碳酸钠显变碳酸氢钠和氯化钠,碳酸氢钠再和盐酸反应生成二氧化碳和水,由于碳酸氢钠溶液显碱性,反应过程中生成碳酸,则溶液中性时溶液中含有NaCl、NaHCO3、CO2(或H2CO3).
故答案为:CO32-+H2O?HCO3-+OH-;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);NaCl、NaHCO3、CO2(或H2CO3).
点评 本题考查结构性质位置关系,为高频考点,涉及常用化学用语、无机推断、元素化合物知识等,注意(2)中物质推断是本题的难点、易错点,D淡黄色为突破口,题目难度中等.

电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.
90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如下(中间产物的固体部分已经略去):
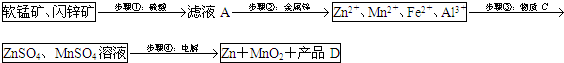
已知各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+
,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+
.产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用.
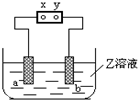 图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的( )
图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的( )| a极板 | b极析 | X电极 | Z溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 负极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
| A. | A | B. | B | C. | D |
| A. | 向Ba(OH)2溶液滴加NaHSO4溶液至沉淀恰好完全:Ba 2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 用Pt 电极电解MgCl2溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 往漂白粉溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | 苯酚钠溶液与氯化铝溶液反应 3C6H5O-+Al3++3H2O═3C6H5OH+Al(OH)3↓ |
| A. | 标准状况下,22.4L SO3中含有的分子数为NA个 | |
| B. | 标准状况下,2.24 L NH3和CH4的混合气体,所含电子总数为2NA | |
| C. | 7.1 g Cl2与足量的铁反应转移的电子数目是0.3NA | |
| D. | 1 mol C5H12分子中共价键总数为16NA |
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水、易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
C6H12O6溶液 $→_{①}^{滴加3%溴水/55℃}$$→_{②}^{过量CaCO_{3}/70℃}$$→_{③}^{趁热过滤}$$→_{④}^{乙醇}$悬浊液$→_{⑤}^{抽滤}$$→_{⑥}^{洗涤}$$→_{⑦}^{干燥}$Ca(C6H11O7)2
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是:B.
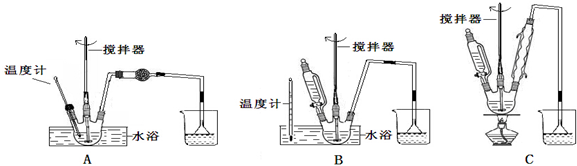
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是C.
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是提高葡萄糖酸的转化率;本实验中不宜用CaCl2替代CaCO3,理由是氯化钙难以与葡萄糖酸直接反应生成葡萄糖酸钙沉淀.
(3)第③步需趁热过滤,其原因是防止葡萄糖酸钙冷却结晶析出.
(4)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙的析出.
(5)第⑥步中,下列洗涤剂最合适的是C.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.
| A. | K+、Cu2+、NO3-、SO42-- | B. | K+、Na+、Cl-、SiO32- | ||
| C. | Al3+、NH4+、NO3-、Cl- | D. | K+、Na+、AlO2-、Cl |
 在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2
在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2