题目内容
19.某混合物的溶液中只含有一下离子中的若干种:K+、Fe3+、Mg2+、Ba2+、NH4+、NO3-、SO42-,现取两份100mL溶液进行如下实验:①第一份加入过量NaOH溶液加热后,收集到0.02mol气体,无沉淀生成.
②第二份加入足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后质量为11.65g.
(1)溶液中一定不存在的离子是Fe3+、Mg2+、Ba2+,不能确定是否存在的离子是NO3-.
(2)溶液中肯定存在的阴离子是SO42-,其浓度为0.5mol/L.
(3)试判断K+是否存在?是(填“是”或“否”),判断的理由是溶液中存在NH4+和SO42-,可能含有NO3-,且n(NH4+)=0.02mol,n(SO42-)=0.05mol,根据电荷守恒可知一定含有钾离子.
分析 ①第一份加入过量NaOH溶液加热后,收集到0.02mol气体,无沉淀生成,说明生成氨气,则含有NH4+,且n(NH4+)=0.02mol,无沉淀生成,则不含Fe3+、Mg2+;
②第二份加入足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后质量为11.65g,说明含有SO42-,则不含Ba2+,且n(SO42-)=$\frac{11.65g}{233g/mol}$=0.05mol,结合电荷守恒解答该题.
解答 解:(1)由以上分析可知溶液中一定不存在的离子是Fe3+、Mg2+、Ba2+,不能确定的是NO3-,故答案为:Fe3+、Mg2+、Ba2+;NO3-;
(2)肯定存在的阴离子是SO42-,浓度为$\frac{0.05mol}{0.1L}$=0.5mol/L,故答案为:SO42-;0.5mol/L;
(3)溶液中存在NH4+和SO42-,可能含有NO3-,且n(NH4+)=0.02mol,n(SO42-)=0.05mol,根据电荷守恒可知一定含有钾离子,
故答案为:是;溶液中存在NH4+和SO42-,可能含有NO3-,且n(NH4+)=0.02mol,n(SO42-)=0.05mol,根据电荷守恒可知一定含有钾离子.
点评 本题考查了常见离子的检验,为高频考点,侧重考查学生的分析能力和实验能力,注意把握离子性质的应用,反应现象的判断,离子共存的分析应用,明确硫酸根离子、铵根离子的分析判断和计算是解答的关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.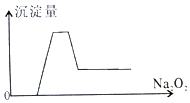 有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )
有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )
①H+②NH4+③Al3+④Mg2+⑤Fe2+⑥NO3-⑦SO42-⑧CO32-.
 有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )
有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )①H+②NH4+③Al3+④Mg2+⑤Fe2+⑥NO3-⑦SO42-⑧CO32-.
| A. | ①②③④⑦ | B. | ①③④⑦ | C. | ①②③⑤⑦ | D. | ①③④⑧ |
4.一种由氯化铵制取氯气的工艺原理如下:
反应Ⅰ.2NH4Cl+MgO$\frac{\underline{\;500~550℃\;}}{\;}$2NH3↑+MgCl2+H2O↑
反应Ⅱ.2MgCl2+O2$\frac{\underline{\;800~1000℃\;}}{\;}$2MgO+2Cl2
下列说法正确的是( )
反应Ⅰ.2NH4Cl+MgO$\frac{\underline{\;500~550℃\;}}{\;}$2NH3↑+MgCl2+H2O↑
反应Ⅱ.2MgCl2+O2$\frac{\underline{\;800~1000℃\;}}{\;}$2MgO+2Cl2
下列说法正确的是( )
| A. | 该工艺中MgO可循环利用 | |
| B. | 理论上 1mol NH4Cl制得Cl2的体积一定为11.2L | |
| C. | 在800~1000℃条件下,O2的还原性强于Cl2的还原性 | |
| D. | 若反应2NH3+MgCl2+H2O═2NH4Cl+MgO能自发进行,则该反应△H>0 |
11.化学与生活、社会密切相关,下列说法不正确的是( )
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于物理变化 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,分别可防止食物受潮、氧化变质 | |
| D. | 采用“静电除尘”“燃煤固硫”、“汽车尾气催化净化”可提高空气质量 |
8.以下现象与电化学腐蚀无关的是( )
| A. | 纯银物品久置表面变暗 | |
| B. | 生铁(含有碳等杂质)比纯铁在潮湿的环境中容易生锈 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
 .
.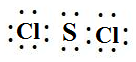 ,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.
,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.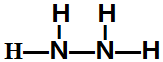 .常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.
.常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.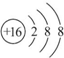 .
.