题目内容
8.下列离子方程式书写正确的是( )| A. | BaCl2溶液与稀H2SO4溶液的反应:Ba2++2Cl-+2H++SO42-═BaSO4↓+2HCl | |
| B. | NaHCO3与NaOH溶液反应:HCO3-+OH-═CO2↑+H2O | |
| C. | 用KSCN检验Fe3+:Fe3++3SCN-═Fe(SCN)3↓ | |
| D. | 盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH-═SiO32-+H2O |
分析 A.氯化氢为强电解质,应拆成离子形式;
B.不符合反应客观事实;
C.Fe(SCN)3不是沉淀;
D.二者反应生成硅酸钠和水.
解答 解:A.BaCl2溶液与稀H2SO4溶液的反应,离子方程式:Ba2++SO42-═BaSO4↓,故A错误;
B.NaHCO3与NaOH溶液反应,离子方程式:HCO3-+OH-═CO32-+H2O,故B错误;
C.用KSCN检验Fe3+,离子方程式:Fe3++3SCN-═Fe(SCN)3,故C错误;
D.盛放碱性试剂的溶液不能用玻璃塞的原因,离子方程式:SiO2+2OH-═SiO32-+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式的书写解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.某化学兴趣小组学生设计了制取KClO3和氯水的实验(装置如图所示),并进行相关性质的探究.
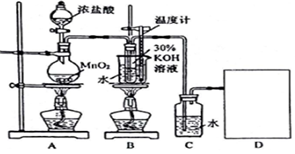
请按要求回答下列问题:
(1)请在D处方框内画出所需装置,并标注试剂名称.
装置A中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;当产生2.24mL(标准状况)Cl2时,转移电子数目为1.204×1022.
(2)B中反应的离子方程式:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O.该小组学生深入研讨后将B和C装置对调了位置,这样做的优点是提高氯酸钾的纯度.
(3)制取实验结束后,取出上图B中试管,经冷却结晶、过滤、洗涤、干燥,得晶体样品.
另取图C中氯水样品,进行如下实验,请分析:
①在少量样品中滴入几滴石蕊溶液后的现象是溶液先变红后褪色.
②测定其中所含氯元素的总量;在一定量试样中加入足量的H2O2溶液,充分反应后加热除去过量的H2O2,冷却,在加入足量的硝酸银溶液,经系列操作后,称取沉淀质量.其中加入的H2O2溶液的作用是将氯气、次氯酸、次氯酸根离子还原为氯离子.
(4)欲证明相同条件下HClO的电离常数大于HCO3-,实验方案是分别测同温度物质的量浓度的次氯酸钠和碳酸氢钠溶液的pH.
(5)在不同条件下KClO3可将KI氧化成I2或KIO3.该小组设计了系列实验研究反应条件对产物的影响,其中某系列实验数据记录如表(均室温下进行);
①此系列实验中a=9.0.此系列实验目的是探究其他条件不变时,硫酸浓度对该反应产物的影响.
②为使实验现象更加明显,此系列实验中还需添加的一种试剂是淀粉溶液.

请按要求回答下列问题:
(1)请在D处方框内画出所需装置,并标注试剂名称.
装置A中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;当产生2.24mL(标准状况)Cl2时,转移电子数目为1.204×1022.
(2)B中反应的离子方程式:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O.该小组学生深入研讨后将B和C装置对调了位置,这样做的优点是提高氯酸钾的纯度.
(3)制取实验结束后,取出上图B中试管,经冷却结晶、过滤、洗涤、干燥,得晶体样品.
另取图C中氯水样品,进行如下实验,请分析:
①在少量样品中滴入几滴石蕊溶液后的现象是溶液先变红后褪色.
②测定其中所含氯元素的总量;在一定量试样中加入足量的H2O2溶液,充分反应后加热除去过量的H2O2,冷却,在加入足量的硝酸银溶液,经系列操作后,称取沉淀质量.其中加入的H2O2溶液的作用是将氯气、次氯酸、次氯酸根离子还原为氯离子.
(4)欲证明相同条件下HClO的电离常数大于HCO3-,实验方案是分别测同温度物质的量浓度的次氯酸钠和碳酸氢钠溶液的pH.
(5)在不同条件下KClO3可将KI氧化成I2或KIO3.该小组设计了系列实验研究反应条件对产物的影响,其中某系列实验数据记录如表(均室温下进行);
| 实验 编号 | 试剂及其用量 | |||
| 0.2mol•L-1kJ/mL | KClO3(s)/g | 6.0mol•L-1H2SO4/mL | H2O/mL | |
| 1 | 1.0 | 0.1 | 0 | a |
| 2 | 1.0 | 0.1 | 3.0 | b |
| 3 | 1.0 | 0.1 | 6.0 | c |
| 4 | 1.0 | 0.1 | 9.0 | 0 |
②为使实验现象更加明显,此系列实验中还需添加的一种试剂是淀粉溶液.
3.下列关于有机化合物的结构、性质的叙述正确的是( )
| A. | 松油醇的结构简式为 ,则其同分异构体可能属于醛类、酮类或芳醇类 ,则其同分异构体可能属于醛类、酮类或芳醇类 | |
| B. | 甲烷和氯气的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 分子式为C4H8O2且能与氢氧化钠溶液反应的有机物(不考虑立体异构和醛类物质)有6种 | |
| D. | 乙醇、乙酸均能与NaOH溶液反应,因为分子中均含有-OH |
7.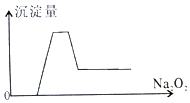 有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )
有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )
①H+②NH4+③Al3+④Mg2+⑤Fe2+⑥NO3-⑦SO42-⑧CO32-.
 有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )
有一透明溶液,取出少量滴入BaCl2溶液,有白色沉淀生成;另取一定体积的该溶液加入过量Na2O2,有无色有刺激性味气体产生,同时有白色沉淀生成,其沉淀量(纵坐标)与加入Na2O2的量(横坐标)的关系如图所示,根据以上判断在该溶液中一定存在的离子是( )①H+②NH4+③Al3+④Mg2+⑤Fe2+⑥NO3-⑦SO42-⑧CO32-.
| A. | ①②③④⑦ | B. | ①③④⑦ | C. | ①②③⑤⑦ | D. | ①③④⑧ |
8.以下现象与电化学腐蚀无关的是( )
| A. | 纯银物品久置表面变暗 | |
| B. | 生铁(含有碳等杂质)比纯铁在潮湿的环境中容易生锈 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
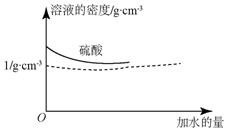 已知硫酸的密度与所加水量的关系如图所示,
已知硫酸的密度与所加水量的关系如图所示, .
.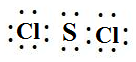 ,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.
,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.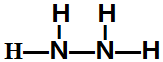 .常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.
.常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.
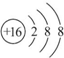 .
.